- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Изотопы. Строение электронных оболочек атомов.
Содержание
- 1. Презентация по химии на тему Изотопы. Строение электронных оболочек атомов.
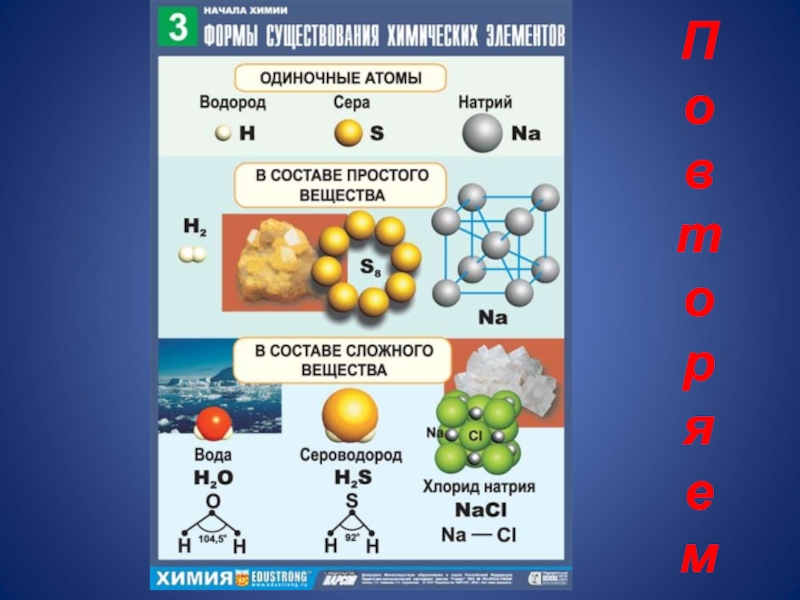
- 2. П о в т о р я е м
- 3. ПовторяемОбозначьте 1в - 7 атомов хлора; 2в
- 4. Повторяем4. Вычислить массовую долю каждого элемента:1в – 5H2SO42в – 8HNO33в – 7BaSO4
- 5. В периодической таблице приведены не целые, а
- 6. Слайд 6
- 7. ИЗОТОПЫ – это разновидности атомов одного
- 8. ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ, КОТОРЫЕ СОСТОЯТ ТОЛЬКО ИЗ РАДИОАКТИВНЫХ ИЗОТОПОВ, НАЗЫВАЮТСЯ РАДИОАКТИВНЫМИ(порядковые номера более 83)
- 9. Почему относительная атомная масса выражается не целым
- 10. Например,Хлор в природе встречается в виде изотопов
- 11. ХИМИЧЕСКИЙ ЭЛЕМЕНТ– это вид атомов с одинаковым
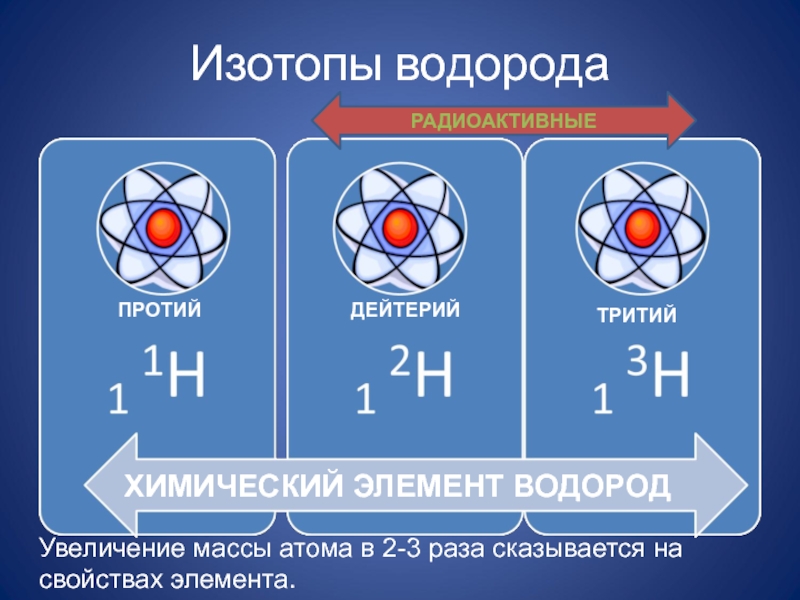
- 12. Изотопы водородаХИМИЧЕСКИЙ ЭЛЕМЕНТ ВОДОРОДПРОТИЙДЕЙТЕРИЙТРИТИЙРАДИОАКТИВНЫЕУвеличение массы атома в 2-3 раза сказывается на свойствах элемента.
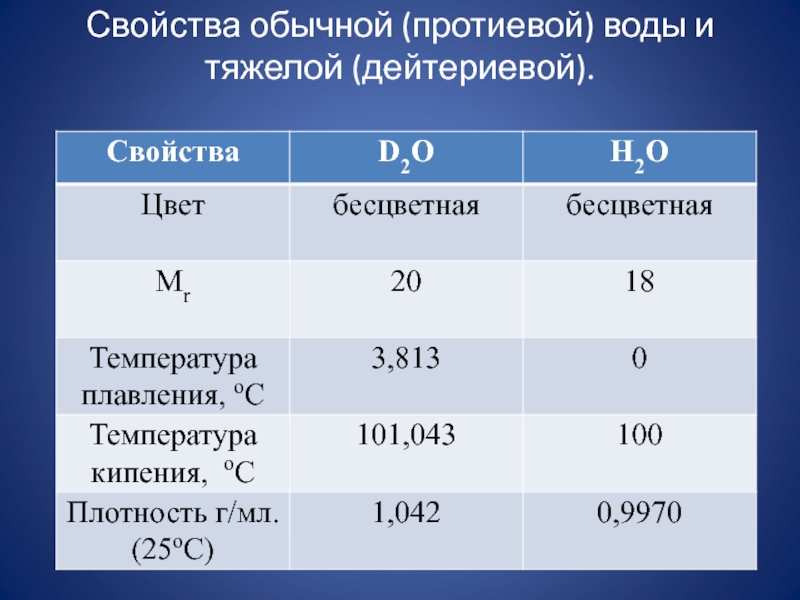
- 13. Свойства обычной (протиевой) воды и тяжелой (дейтериевой).
- 14. Объясните, почему в периодической таблице в некоторых случаях
- 15. Это зависит от того, каких изотопов (легких
- 16. физкультминуткаАтом наш не так уж прост.Чуть на
- 17. Строение электронных оболочек атомов
- 18. ЧТО ТАКОЕЭЛЕКТРОН?
- 19. • é – это частица! m0=0,9109534*10 -27 гZ=1,6021892*10 -19 Кл
- 20. é – волна!обладает большой СКОРОСТЬЮ и
- 21. Местоположение электронов в пространстве в данный момент времени определить невозможно.
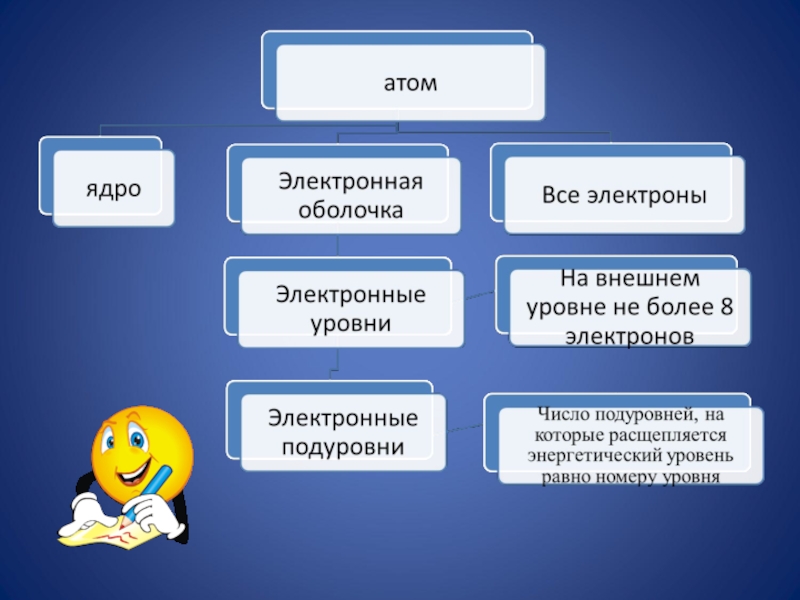
- 22. Все электроны атома образуют егоЭЛЕКТРОННУЮ ОБОЛОЧКУ
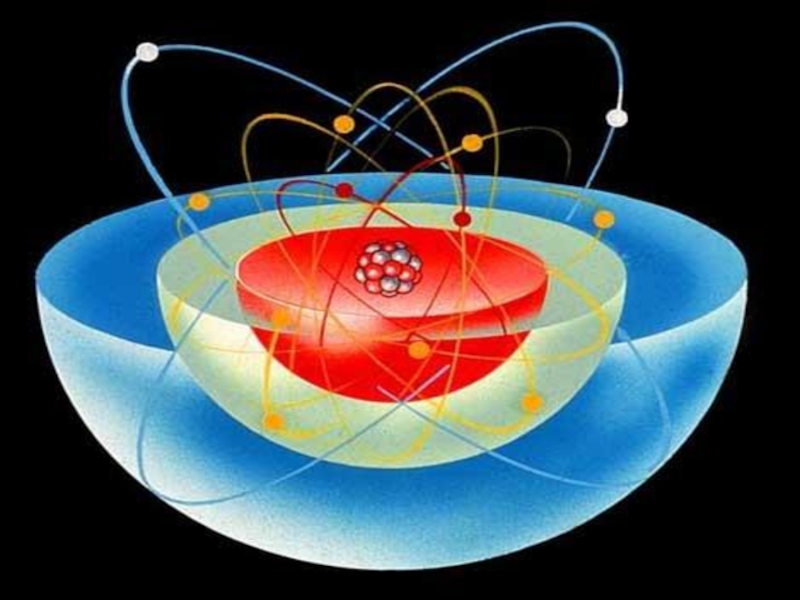
- 23. Ядро – "Солнце".Электроны – "планеты".Планетарная модель атома
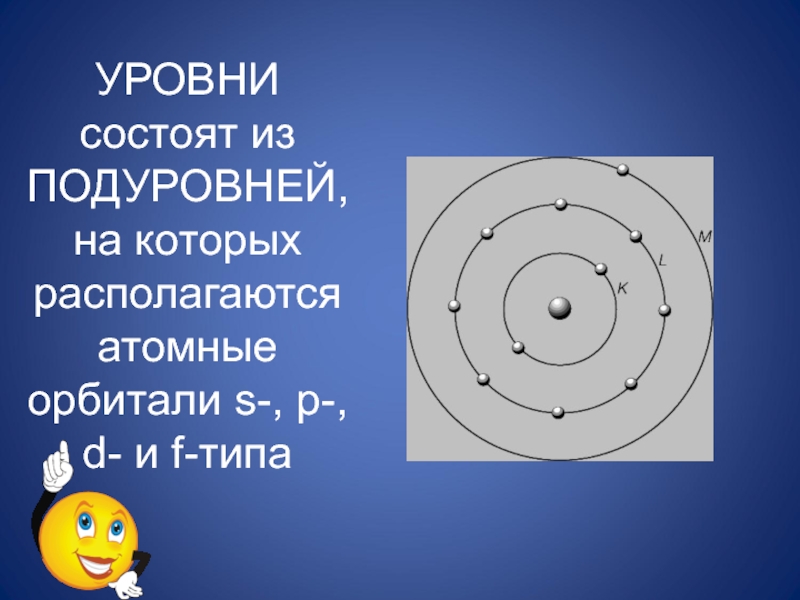
- 24. ЭЛЕКТРОННАЯ ОБОЛОЧКА ДЕЛИТСЯ НАУРОВНИ СЛОИИЗВЕСТНО 7 ЭНЕРГЕТИЧЕСКИХ УРОВНЕЙ, РАСПОЛОЖЕННЫХ НА РАЗНЫХ РАССТОЯНИЯХ ОТ ЯДРА
- 25. Слайд 25
- 26. Слайд 26
- 27. УРОВНИ состоят из ПОДУРОВНЕЙ, на которых располагаются атомные орбитали s-, p-, d- и f-типа
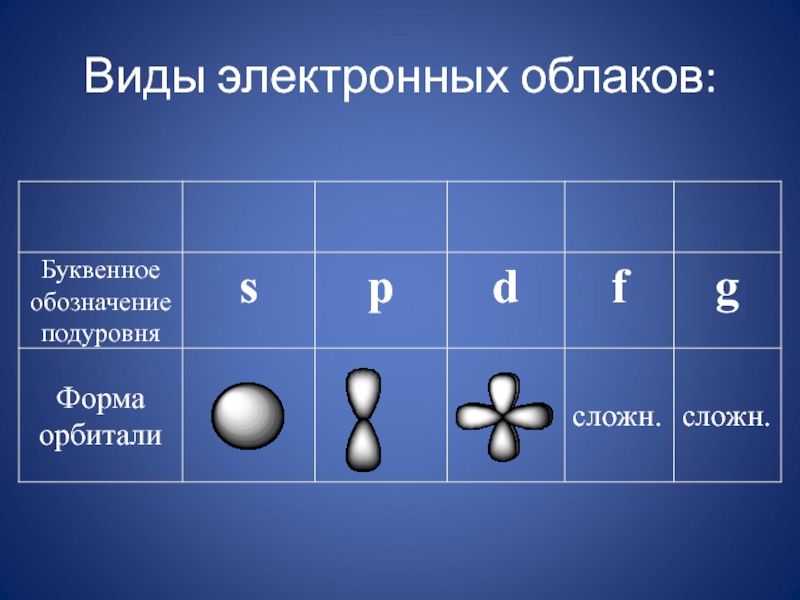
- 28. Виды электронных облаков:
- 29. Число подуровней, на которые расщепляется энергетический уровень равно номеру уровня. Например,
- 30. 1 уровень – s- подуровень,2 уровень –
- 31. s-подуровень 1 АО р-подуровень
- 32. Слайд 32
- 33. Домашнее задание§ 7,8упр. в конце параграфа 8Написать электронные формулы первых 20 элементов и выучить.
Слайд 3Повторяем
Обозначьте
1в - 7 атомов хлора;
2в - 3 молекулы хлора;
Определите число протонов , нейтронов и электронов в атомах:
1в - Алюминия и кислорода
2в - Фтора и калия
3в - Кальция и азота.
Какие частицы атома имеют
а)массу б)заряд?
Слайд 5В периодической таблице приведены не целые, а дробные значения относительных атомных
Оказывается, в природе существуют атомы одного и того же химического элементы с разной атомной массой
Слайд 7ИЗОТОПЫ
– это разновидности атомов одного химического элемента, которые отличаются
Изотопы (от «изо» - равный и «топос» – место), т.е. занимающий одно место в таблице Менделеева.
Слайд 8ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ, КОТОРЫЕ СОСТОЯТ ТОЛЬКО ИЗ РАДИОАКТИВНЫХ ИЗОТОПОВ, НАЗЫВАЮТСЯ РАДИОАКТИВНЫМИ
(порядковые номера
Слайд 9Почему относительная атомная масса выражается не целым числом?
ОТНОСИТЕЛЬНАЯ АТОМНАЯ МАССА
Слайд 10Например,
Хлор в природе встречается в виде изотопов 35Cl (75%) и 37Cl
Вычислите относительную атомную массу хлора:
Ar = 35∙0,75 + 37∙0,25 = 35,5
ХИМИЧЕСКИЙ ЭЛЕМЕНТ представляет собой
совокупность его изотопов
Слайд 11ХИМИЧЕСКИЙ ЭЛЕМЕНТ
– это вид атомов
с одинаковым зарядом ядра.
Химические свойства изотопов
ХИМИЧЕСКИЙ ЭЛЕМЕНТ
– это определенный вид атомов.
Слайд 12Изотопы водорода
ХИМИЧЕСКИЙ ЭЛЕМЕНТ ВОДОРОД
ПРОТИЙ
ДЕЙТЕРИЙ
ТРИТИЙ
РАДИОАКТИВНЫЕ
Увеличение массы атома в 2-3 раза сказывается на
Слайд 14Объясните,
почему в периодической таблице в некоторых случаях элементы с большей относительной
Например: аргон и калий, теллур и йод, кобальт и никель, уран и нептуний, менделевий и нобелий.
Слайд 15Это зависит от того, каких изотопов (легких или тяжелых) у данного
У калия – больше легких изотопов, а у аргона – тяжелых.
Слайд 16физкультминутка
Атом наш не так уж прост.
Чуть на шарик он похож.
Что в
Вокруг кружится электрон.
На него ты посмотри,
Поводи глазами, отдохни.
Слайд 20 é – волна!
обладает большой СКОРОСТЬЮ и ЭНЕРГИЕЙ
За долю секунды электрон
ЭЛЕКТРОННОЕ ОБЛАКО
или АТОМНАЯ ОРБИТАЛЬ
Слайд 24ЭЛЕКТРОННАЯ ОБОЛОЧКА
ДЕЛИТСЯ НА
УРОВНИ
СЛОИ
ИЗВЕСТНО 7 ЭНЕРГЕТИЧЕСКИХ УРОВНЕЙ,
РАСПОЛОЖЕННЫХ НА РАЗНЫХ РАССТОЯНИЯХ ОТ
Слайд 29Число подуровней, на которые расщепляется энергетический уровень равно номеру уровня. Например,
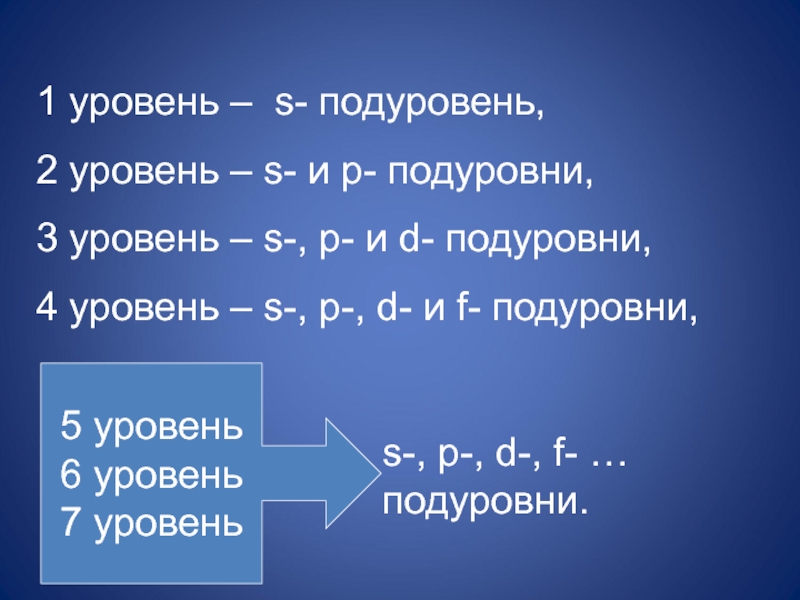
Слайд 301 уровень – s- подуровень,
2 уровень – s- и p- подуровни,
3
4 уровень – s-, p-, d- и f- подуровни,
5 уровень
6 уровень
7 уровень
s-, p-, d-, f- … подуровни.
Слайд 31s-подуровень 1 АО
р-подуровень 3 АО
d-подуровень
f-подуровень 7 АО
ИТАК, имеем
1s2s2p3s3p3d4s4p4d4f5s5p5d5f…
6s6p6d6f…7s7p7d7f…