- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Изменение свойств химических элементов в группвх и периодах (8 класс)
Содержание
- 1. Презентация по химии на тему Изменение свойств химических элементов в группвх и периодах (8 класс)
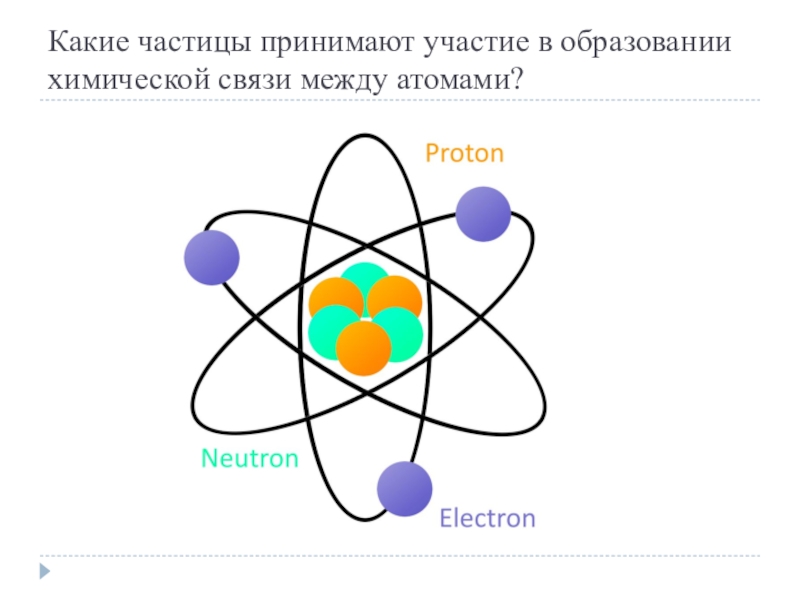
- 2. Какие частицы принимают участие в образовании химической связи между атомами?
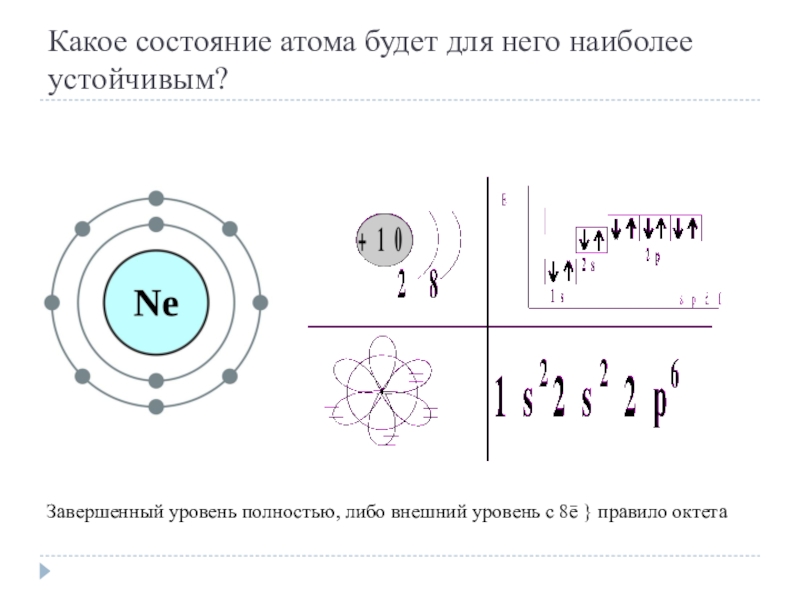
- 3. Какое состояние атома будет для него наиболее
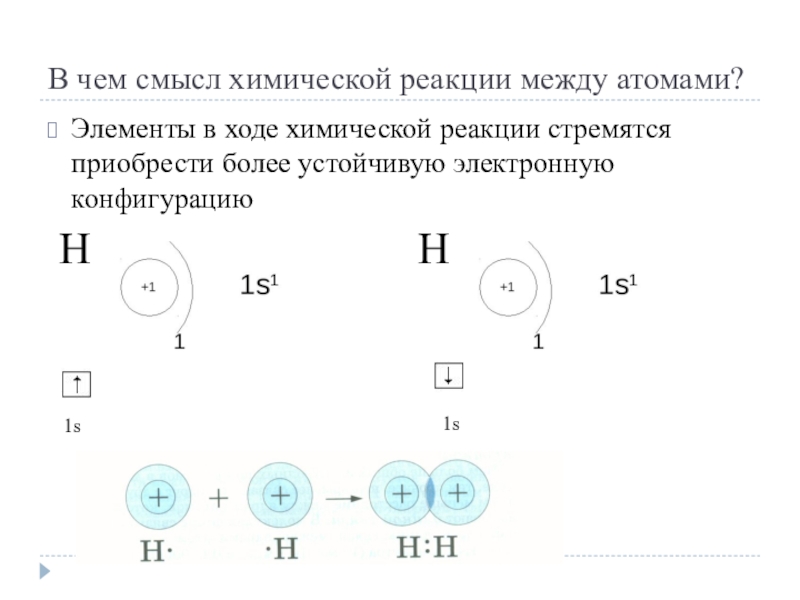
- 4. В чем смысл химической реакции между атомами?Элементы
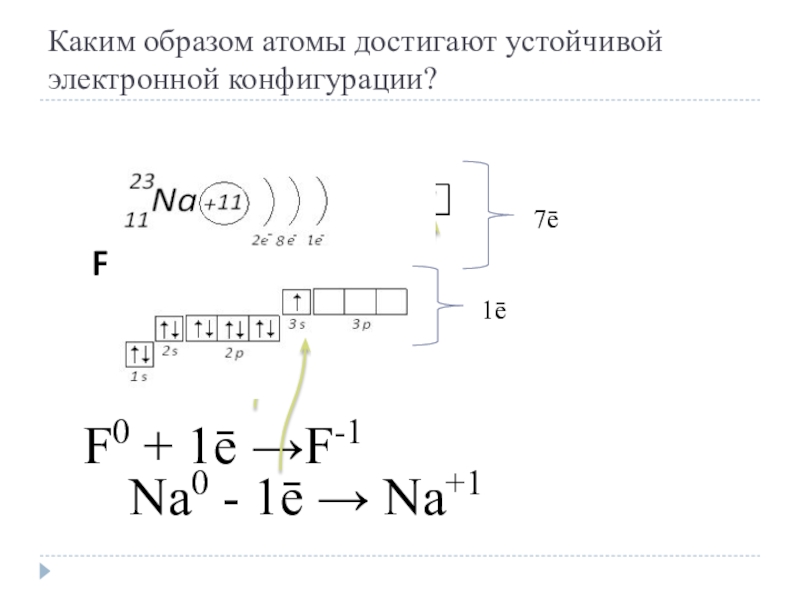
- 5. Каким образом атомы достигают устойчивой электронной конфигурации? F0 + 1ē →F-17ēNa0 - 1ē → Na+1 1ē
- 6. ИоныNa + F → Na
- 7. Изменение свойств элементов в группах (А) сверху
- 8. Изменение свойств элементов в периодах (А) слева
- 9. Одинакова ли способность притягивать электроны атомами?Электроотрицательность –
Какие частицы принимают участие в образовании химической связи между атомами?
Слайд 3Какое состояние атома будет для него наиболее устойчивым?
Завершенный уровень полностью, либо
внешний уровень с 8ē } правило октета
Слайд 4В чем смысл химической реакции между атомами?
Элементы в ходе химической реакции
стремятся приобрести более устойчивую электронную конфигурацию
Н
Н
1s
1s
Слайд 5Каким образом атомы достигают устойчивой электронной конфигурации?
F0 + 1ē →F-1
7ē
Na0 -
1ē → Na+1
1ē
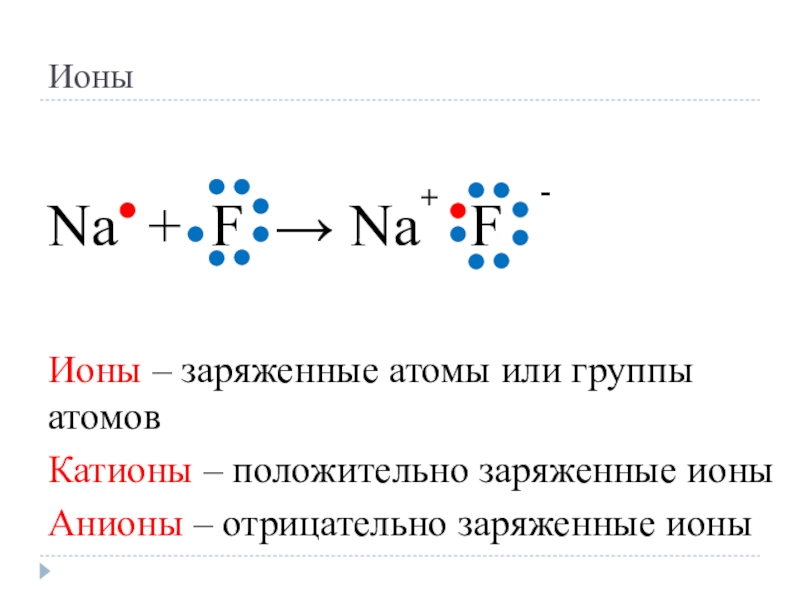
Слайд 6Ионы
Na + F → Na F
Ионы – заряженные атомы
или группы атомов
Катионы – положительно заряженные ионы
Анионы – отрицательно заряженные ионы
Катионы – положительно заряженные ионы
Анионы – отрицательно заряженные ионы
+
-
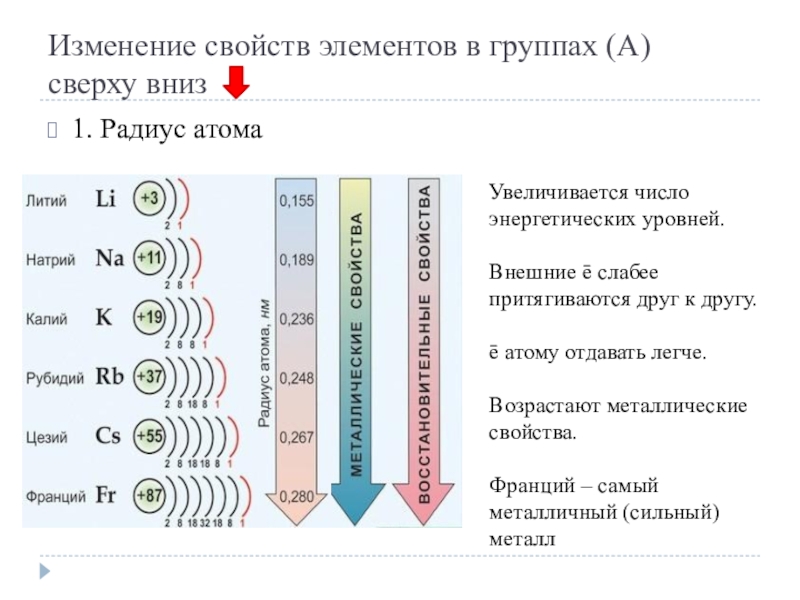
Слайд 7Изменение свойств элементов в группах (А)
сверху вниз
1. Радиус атома
Увеличивается число
энергетических уровней.
Внешние ē слабее притягиваются друг к другу.
ē атому отдавать легче.
Возрастают металлические свойства.
Франций – самый металличный (сильный) металл
Внешние ē слабее притягиваются друг к другу.
ē атому отдавать легче.
Возрастают металлические свойства.
Франций – самый металличный (сильный) металл
Слайд 8Изменение свойств элементов в периодах (А)
слева направо
1. Радиус атома
Увеличивается число электронов
на внешнем уровне → они сильнее притягиваются к ядру → радиус меньше.
ē атому отдавать сложнее.
Na Iгр 1ē → отдать легче
F VIIгр 7ē → отдать сложнее
Возрастают неметаллические свойства.
Фтор – самый сильный неметалл
ē атому отдавать сложнее.
Na Iгр 1ē → отдать легче
F VIIгр 7ē → отдать сложнее
Возрастают неметаллические свойства.
Фтор – самый сильный неметалл
Слайд 9Одинакова ли способность притягивать электроны атомами?
Электроотрицательность – способность атома притягивать валентные
электроны другого атома.
Степень окисления – условный заряд, который принимает атом в результате полной отдачи или принятия электронов.
Окислитель – + ē
Восстановитель – - ē
Степень окисления – условный заряд, который принимает атом в результате полной отдачи или принятия электронов.
Окислитель – + ē
Восстановитель – - ē