- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Инновационные технологии в химии
Содержание
- 1. Презентация по химии на тему Инновационные технологии в химии
- 2. .Послушай - и ты узнаешь,Посмотри - и ты поймёшь,Сделай - и ты научишьсяЗачем мне это надо?
- 3. Слайд 3
- 4. Цели и задачи
- 5. АктуальностьУспех в учении – один из источников
- 6. Тема: Изучение темы «Кремний и его свойства
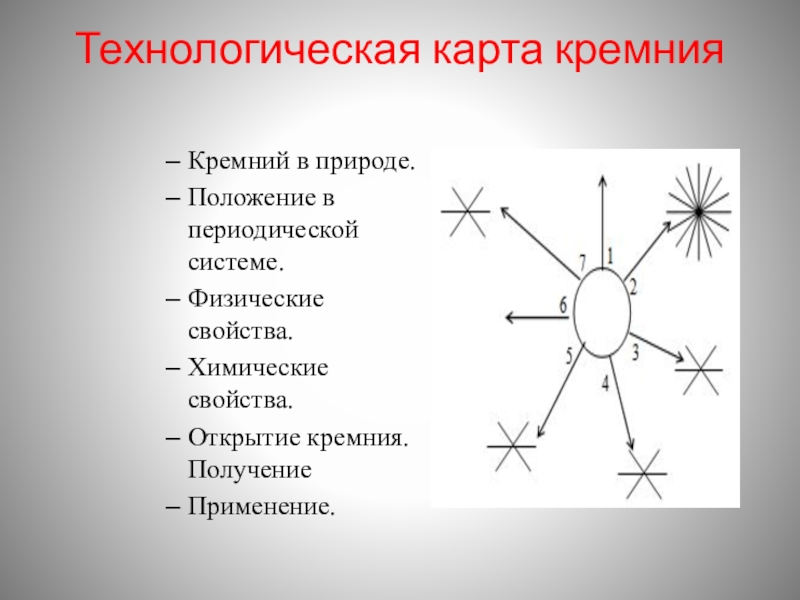
- 7. Технологическая карта кремния Кремний в природе.Положение в периодической системе.Физические свойства.Химические свойства.Открытие кремния.ПолучениеПрименение.
- 8. Ход урока После разъяснения учителя ученики
- 9. Вопросы группамВопрос №1. Кремний в природе. Опишите
- 10. Правила работы в группах При обучении
- 11. Кремний в природеКремний встречается в природе в
- 12. Положение химического элемента кремния в периодической системе
- 13. Физические свойства кремния1гр. Различают амфорный и кристаллический
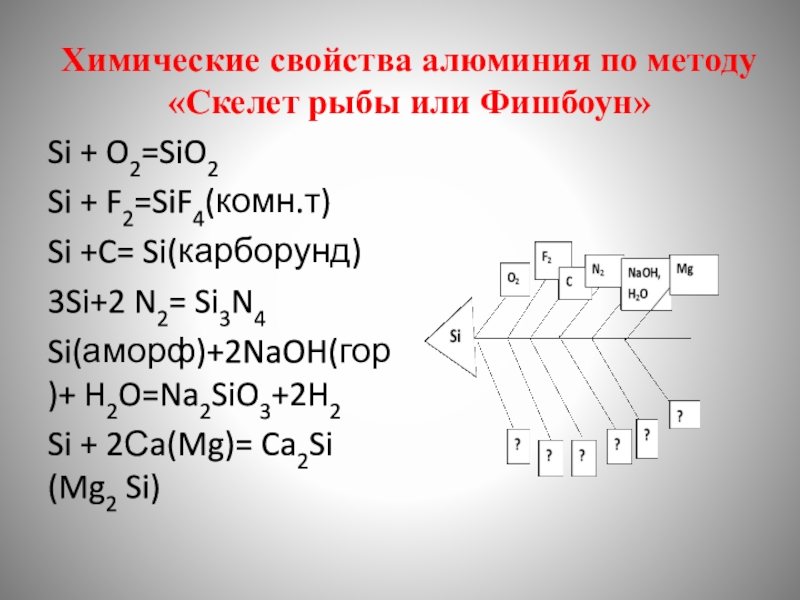
- 14. Химические свойства алюминия по методу «Скелет рыбы
- 15. Открытие кремния и получение1.SiO2 +2C= 2CO+ Si(высокая
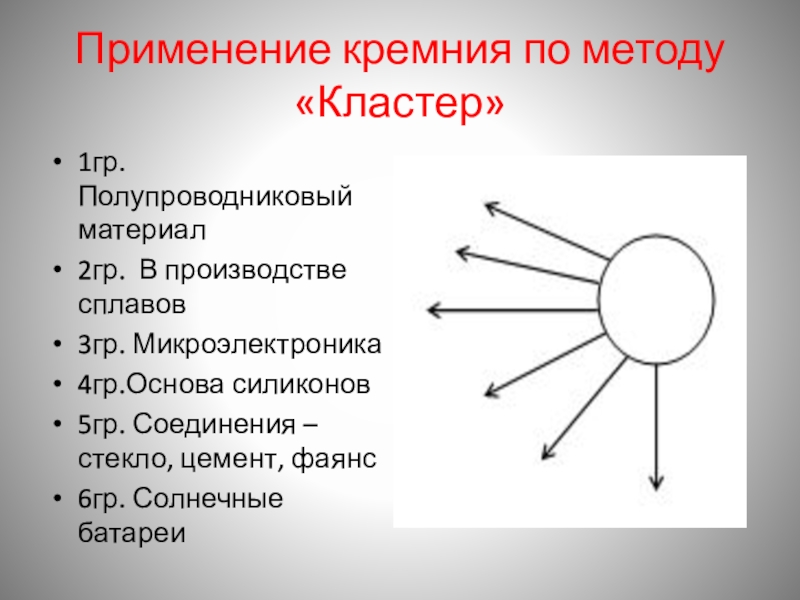
- 16. Применение кремния по методу «Кластер»1гр. Полупроводниковый материал2гр.
- 17. Проверка работы групп Обсуждение вопросов урока,
- 18. Рефлексия – одним словомУчащимся необходимо выбрать 3
- 19. Творческое заданиеЗадача 1. Назовите этот элемент по
- 20. Ответы к творческому заданиюЭтот элемент – кремний
Слайд 3 Что же
Слайд 4Цели и задачи
Раскрыть сущность условий, при
а) Обучающая: организовать деятельность учащихся по восприятию, осмыслению и запоминанию новых знаний;
б) Развивающая: продолжить формирование выделять главное, развивать умение наблюдать, сравнивать, делать выводы, совершенствовать умение высказывать и обосновывать суждения; развивать навыки работы в группах.
в) Воспитательная: показать учащимся значение теоретических знаний для объяснения химических явлений, раскрыть учащимся важные области применения знаний, ознакомление учащихся с основными закономерностями протекания химических реакций, воспитывать у учащихся чувства коллективизма, толерантности.
Слайд 5Актуальность
Успех в учении – один из источников внутренних сил школьника, рождающий
Слайд 6Тема: Изучение темы «Кремний и его свойства
Учитель разъясняет: элемент
Кремень –камень
1824г.Я. Берцелиус
Слайд 7Технологическая карта кремния
Кремний в природе.
Положение в периодической системе.
Физические свойства.
Химические свойства.
Открытие
Применение.
Слайд 8Ход урока
После разъяснения учителя ученики разделяются на 6 групп.
Учащимся
Раздаются вопросы представителям групп.
Объясняется ход урока.
Даётся время для подготовки ответа.
Ученики самостоятельно читают текст темы, и они должны заранее принести новый материал по новой теме. Для каждой группы на столе заготовки бумаги для подсолнуха, фломастер, раздаточный материал. Даётся время для подготовки ответа.
Слайд 9Вопросы группам
Вопрос №1. Кремний в природе. Опишите по методу «Цветок подсолнуха».
Вопрос №2. Какое положение кремния в периодической системе? По методу «Цветок подсолнуха».
Вопрос№3. Физические свойства кремния, используя метод «Кластера»
Вопрос№4. Химические свойства кремния, используя метод «Фишбоун»
Вопров№5. Открытие кремния. Получение,
используя метод «Круговерть».
Вопрос№6. Применение кремния ,используя метод «Кластера»
Слайд 10Правила работы в группах
При обучении элемента алюминия надо знать
1гр.-ответ: нахождение кремния в природе,
2гр.-ответ :положение в периодической системе,
3гр.-ответ: физические свойства,
4гр.-ответ: химические свойства,
5гр.-ответ:открытие кремния,получение,
6гр.- ответ: применение кремния.
Слайд 11Кремний в природе
Кремний встречается в природе в виде соединений:
Кремнезем:
Каолинит ( полевой шпат ):
Ортоглаз:
Кремний – второй элемент после кислорода по распространённости в земной коре
Слайд 12Положение химического элемента кремния в периодической системе
Каждая группа
1гр.- химический знак Si, 3 период, IV гл. п/гр.
2гр.- 3 ряд, неметалл.
3гр- «-4,0,+4»- степени окисления,№14
4гр- атомная масса-28, SiO2-кислород. соединени-
5гр- водородн соед – SiH4, атом.строен. +) 2 ) 6)4
6гр- p =+14 e = - 13 n = 14, эл.конф.1S22S2 2P6 3S2 3p2
Слайд 13Физические свойства кремния
1гр. Различают амфорный и кристаллический кремний,
2гр. Кристаллический кремний –
3гр. Амфорный кремний – белый или бурый порошок, более реакционноспособный
4гр.Полупроводник ,кристал.решетка атомная
5гр. плавится 14150С
6гр. Кипит при 2349 0С
Слайд 14Химические свойства алюминия по методу «Скелет рыбы или Фишбоун»
Si + O2=SiO2
Si
Si +C= Si(карборунд)
3Si+2 N2= Si3N4
Si(аморф)+2NaOH(гор)+ H2O=Na2SiO3+2H2
Si + 2Сa(Mg)= Ca2Si (Mg2 Si)
Слайд 15Открытие кремния и получение
1.SiO2 +2C= 2CO+ Si(высокая тем.,пром.)
2.SiF4 =Si+ 2H2
3. SiCl4+2
4. SiO2+ 2Mg= 2MgO+Si (или)
3SiO2+ 4Al=2 Al 2O3+ 3 Si (лабор)
1811 год Франция Ж.Л. Гей-Люссак и Л.Ж. Тенар- получили буро-коричневое вещество кремний
1824 год И. Берцелиус Швеция получил и доказал кремний
Слайд 16Применение кремния по методу «Кластер»
1гр. Полупроводниковый материал
2гр. В производстве сплавов
3гр. Микроэлектроника
4гр.Основа
5гр. Соединения –стекло, цемент, фаянс
6гр. Солнечные батареи
Слайд 17Проверка работы групп
Обсуждение вопросов урока, рекомендации учителя по вопросам,
Шкала самооценки
Слайд 18Рефлексия – одним словом
Учащимся необходимо выбрать 3 слова из 12, которые
Раздражение
Злость
Радость
Равнодушие.
Удовлетворение
Вдохновение
Скука.
Тревога.
Покой.
Уверенность
Неуверенность.
Наслаждение.
Слайд 19Творческое задание
Задача 1. Назовите этот элемент по следующим данным: название его
Задача 2. Этот элемент образует кислородное соединение, составляющее главную часть песка и глины. Оксид очень твердый, тугоплавкий, единственный из кислотных оксидов, не взаимодействующих с водой: действительно, реки веками текут по руслу из песка, не растворяя его. Из него состоит минерал кремнезем, из которого первобытные люди изготавливали топор. Определите молекулярную формулу этого оксида по данным: относительная молекулярная масса вещества равна 60, а массовая доля кислорода составляет 53,3 %.