- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Хром, молибден,вольфрам. 11 класс.
Содержание
- 1. Презентация по химии на тему: Хром, молибден,вольфрам. 11 класс.
- 2. Слайд 2
- 3. Общая характеристика элементов VIB подгруппы
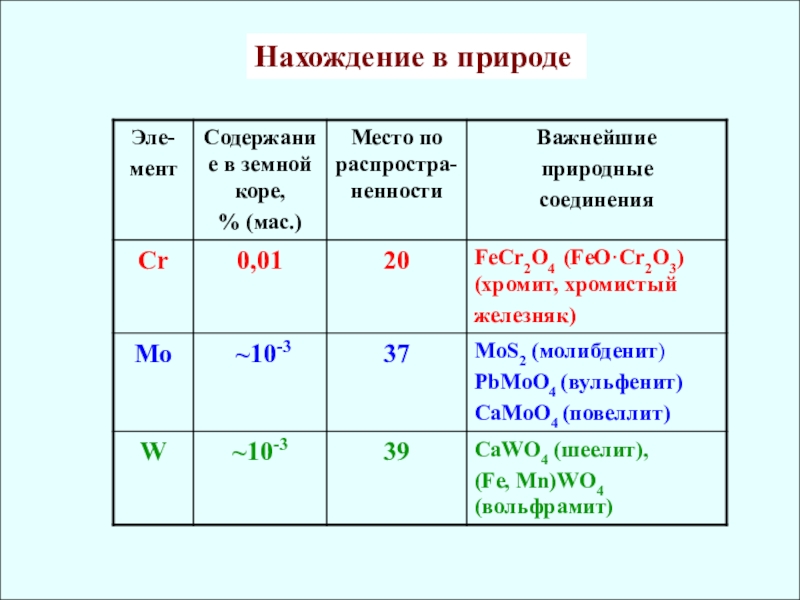
- 4. Нахождение в природе
- 5. Cвойства Cr, Mo, WТвердые, тяжелые, тугоплавкие металлыW – самый тугоплавкий металлСr – самый твердый металл
- 6. Cr + H2SO4 (разб.) → СrSO4 +
- 7. Кислотно-основные свойcтва оксидов и гидроксидовCrO Cr(OH)2
- 8. Cr(OH)3 + H2SO4 = Cr2(SO4)3 + H2OCr(OH)3
- 9. Соединения Cr, Mo, W+VIK2Cr2O7 + H2SO4 (конц.)
- 10. CВ кислой среде хроматы переходят в дихроматы:СrO42-
- 11. Слайд 11
- 12. K2Cr2O7 + HCl (конц.) → СrCl3 +
- 13. Cr2O72– + SO32– + H+ → Cr3+
- 14. +VIMo + O2 → MoO3 (T =
- 15. Вольфрам. Изополисоединения. [H2W12O42]10-- паравольфрамат Б-ион; [H2W12O40]6-- метавольфрамат-ион[W7O24]6--
- 16. +III(NH4)2Cr2O7 → Cr2O3 + N2 ↑ +
- 17. Слайд 17
- 18. Слайд 18
- 19. Слайд 19
- 20. CrIIICrVICr3+[Cr(OH)6]3-Cr2O72-CrO42-H+H+OH-OH-Схема переходов CrIII в CrVI в различных средах+ восстановитель+ окислитель
- 21. +IICr + HCl → CrCl2 + H2
- 22. tCrO3 + Al Cr
- 23. Дополнительный материал к лекции № 12Хром, молибден,
- 24. ХромВ металлургии для получения легированных сталей более
- 25. Получение феррохромаДля выплавки феррохрома применяют хромовую руду
- 26. Содержание углерода в феррохроме может достигать 8
- 27. Одновременно протекают реакции восстановления карбидов хрома и
- 28. Получение хромаПолучение металлического хрома из природного хромистого
- 29. Металлический хром получают электролизом растворов солей хрома
- 30. МолибденМолибденит (MoS2) – наиболее распространенный и промышленно
- 31. 3. Выщелачивание. Огарок выщелачивают раствором аммиака. Выщелачивание
- 32. 6. Получение порошков молибдена.Наиболее распространен в промышленной
Слайд 3
Общая характеристика элементов
VIB подгруппы
Эл. cтроение
Cr [Ar] 3d54s1 0,126 II, III, VI
Mo [Kr] 4d55s1 0,136 (IV, V), VI
W [Xe] 4f145d46s2 0,137 (IV, V), VI
✔ r Mo ≈ r W как следствие лантаноидного сжатия
✔ Склонность к проявлению высшей СО растёт
✔ Убывание кислотных свойств (H2CrO4 и H2MoO4)
✔ Активные комплексообразователи (изополи- и
гетерополисоединения)
Слайд 5
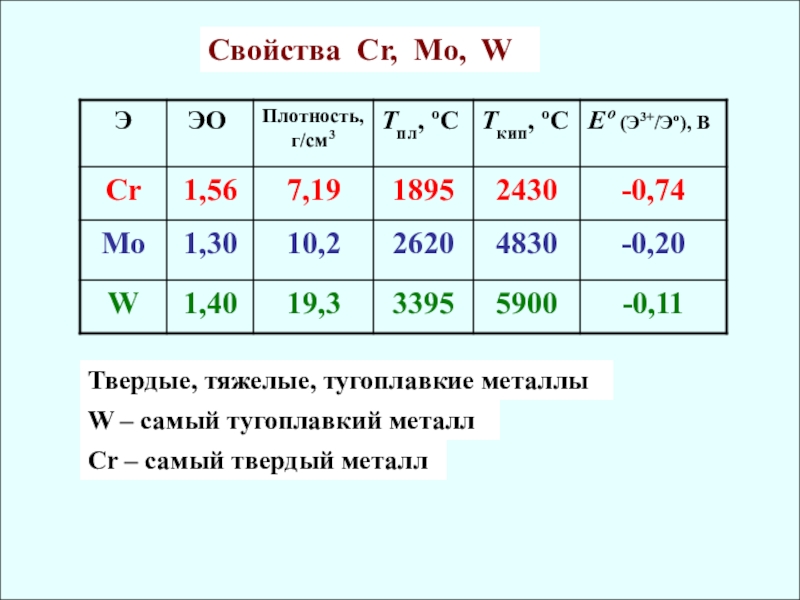
Cвойства Cr, Mo, W
Твердые, тяжелые, тугоплавкие металлы
W – самый тугоплавкий металл
Сr
Слайд 6
Cr + H2SO4 (разб.) → СrSO4 + H2↑
Mo + H2SO4 (конц.)
W + HNO3 + HF → H2[WF8] +NO↑+ H2O
Cr + O2 + NaOH = Na2CrO4 + H2O
Окислительное щелочное плавление
Слайд 7
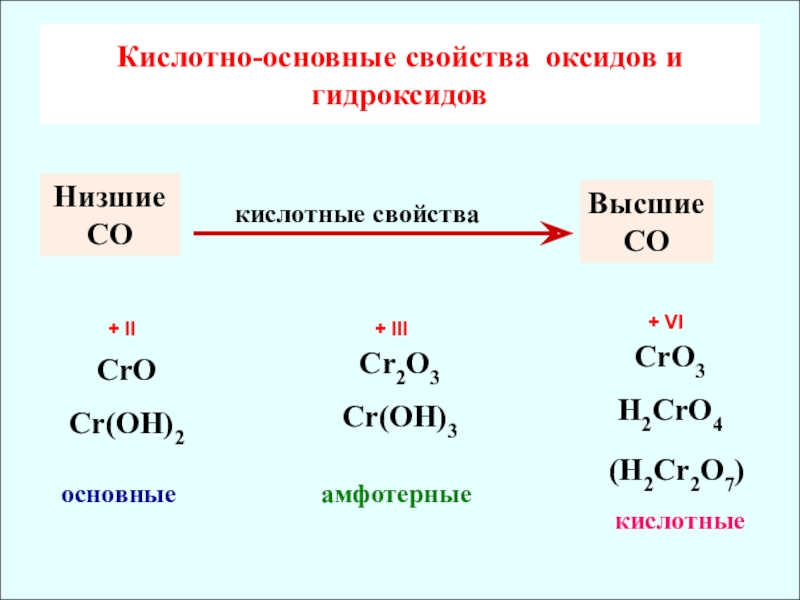
Кислотно-основные свойcтва оксидов и гидроксидов
CrO
Cr(OH)2
основные
Cr2O3
Cr(OH)3
CrO3
H2CrO4
амфотерные
кислотные
Низшие
Высшие СО
кислотные свойства
(H2Cr2O7)
+ II
+ III
+ VI
Слайд 8
Cr(OH)3 + H2SO4 = Cr2(SO4)3 + H2O
Cr(OH)3 + NaOH = Na[Cr(OH)4]
тетрагидроксохромит
Cr2O3 + NaOH = NaCrO2 + H2O
хромит натрия
t
СrO3
- кислотный оксид
CrO3 + KOH = K2CrO4 + H2O
хромат калия
- ярко красные кристаллы
при сплавлении
Слайд 9
Соединения Cr, Mo, W
+VI
K2Cr2O7 + H2SO4 (конц.) → CrO3↓ + K2SO4
CrO3 → Cr2O3 + O2 (T > 400 °C)
cильный
окислитель
CrO3 + Н2О → H2CrO4
? PbCrO4, BaCrO4, Ag2CrO4
Хорошо р-римы хроматы щелочных металлов и аммония
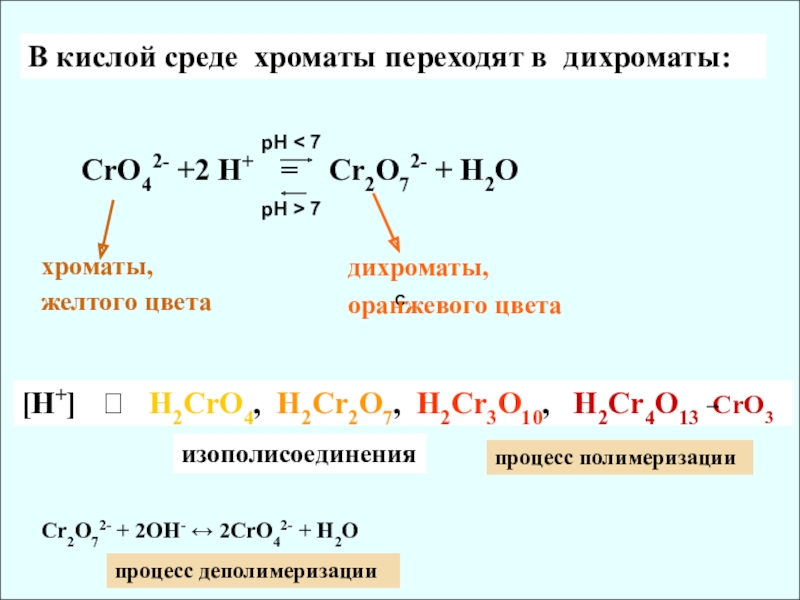
Слайд 10C
В кислой среде хроматы переходят в дихроматы:
СrO42- +2 H+
хроматы,
желтого цвета
дихроматы,
оранжевого цвета
pH < 7
pH > 7
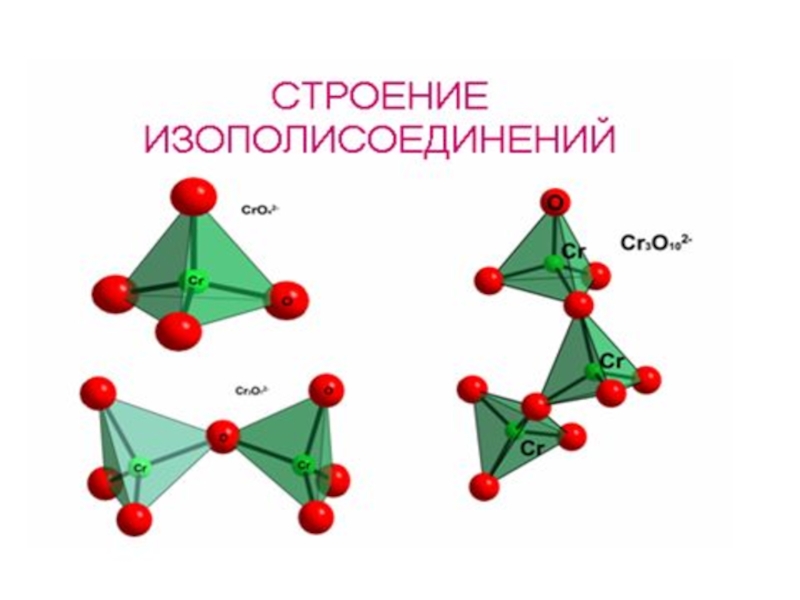
[H+] ? H2CrO4, H2Cr2O7, H2Cr3O10, H2Cr4O13 CrO3
изополисоединения
Cr2O72- + 2OH- ↔ 2CrO42- + H2O
процесс полимеризации
процесс деполимеризации
Слайд 12
K2Cr2O7 + HCl (конц.) → СrCl3 + Cl2↑+ KCl + H2O
☞
Самостоятельно
с применением метода полуреакций
Дихроматы - сильные окислители:
K2Cr2O7 + KI + H2SO4 = I2 + Cr2(SO4)3 + K2SO4 +H2O
Слайд 13
Cr2O72– + SO32– + H+ → Cr3+ + SO42– + H2O
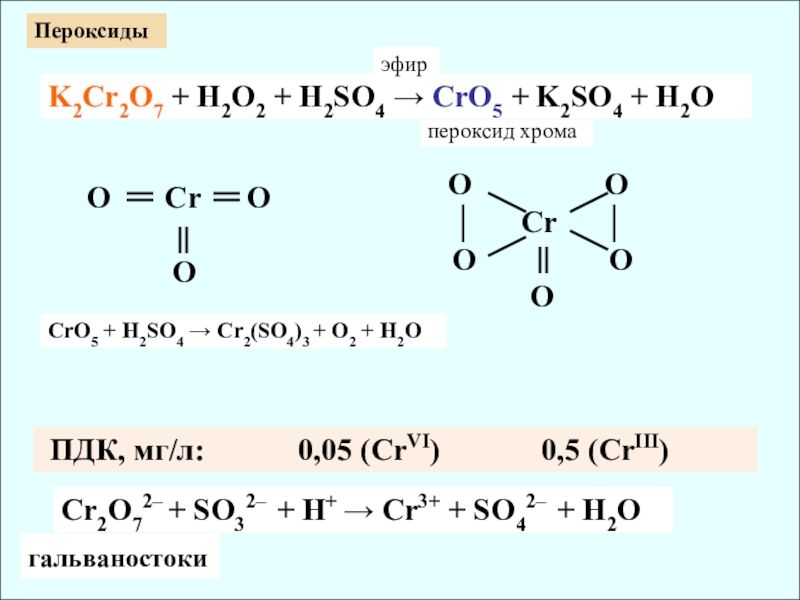
K2Cr2O7 + H2O2 + H2SO4 → CrO5 + K2SO4 + H2O
O Cr O
O
O O
│ Cr │
O O
O
эфир
пероксид хрома
гальваностоки
Пероксиды
СrO5 + H2SO4 → Cr2(SO4)3 + O2 + H2O
Слайд 14
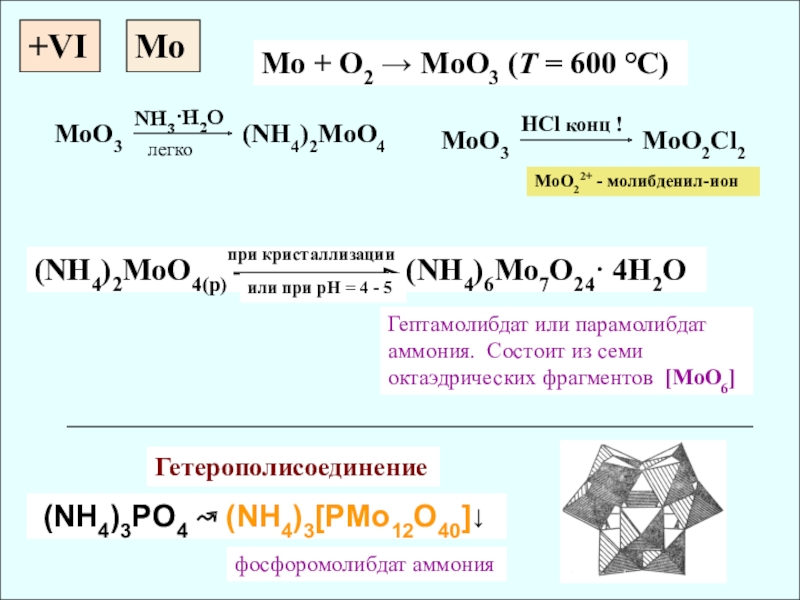
+VI
Mo + O2 → MoO3 (T = 600 °C)
(NH4)2MoO4(p)
(NH4)3PO4 ↝ (NH4)3[PMo12O40]↓
при кристаллизации
Гептамолибдат или парамолибдат аммония. Cостоит из семи октаэдрических фрагментов [MoO6]
Гетерополисоединение
фосфоромолибдат аммония
Mo
NH3·H2O
легко
MoO3 (NH4)2MoO4
MoO3 MoO2Cl2
HCl конц !
MoO22+ - молибденил-ион
или при рН = 4 - 5
Слайд 15
Вольфрам. Изополисоединения.
[H2W12O42]10-
- паравольфрамат Б-ион;
[H2W12O40]6-
- метавольфрамат-ион
[W7O24]6-
- паравольфрамат А-ион
Na2MoO4 —→ 3MoO3
Молибденовые и вольфрамовые сини
(W5O14)
Mo4O11, Mo8O23, Mo9O26, W18O49, W20O58, W24O70 и т.д.
Zn
H+
VI
V
Слайд 16
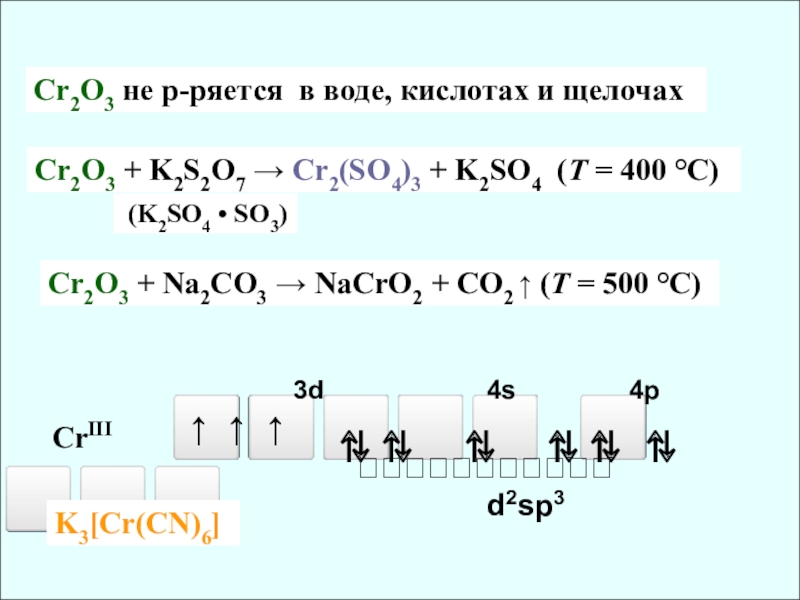
+III
(NH4)2Cr2O7 → Cr2O3 + N2 ↑ + H2O ↑ (T =
лабораторный способ получения оксида хрома (III)
Слайд 17
CrIII
3d 4s 4p
⇅ ⇅ ⇅ ⇅ ⇅ ⇅
↑ ↑ ↑
d2sp3
Cr2O3 + Na2CO3 → NaCrO2 + CO2 ↑ (T = 500 °C)
Cr2O3 + K2S2O7 → Cr2(SO4)3 + K2SO4 (T = 400 °C)
(K2SO4 • SO3)
Cr2O3 не р-ряется в воде, кислотах и щелочах
K3[Cr(CN)6]
Слайд 18
[Cr(H2O)6]3+
……
[Cr(H2O)3(OH)3]0
[Cr(H2O)2(OH)4]–
……
[Cr(OH)6]3–
Cr3+
CrOH2+
Cr(OH)3 ↓
[Cr(OH)4]–
[Cr(OH)6]3–
Условно:
pH
Слайд 19
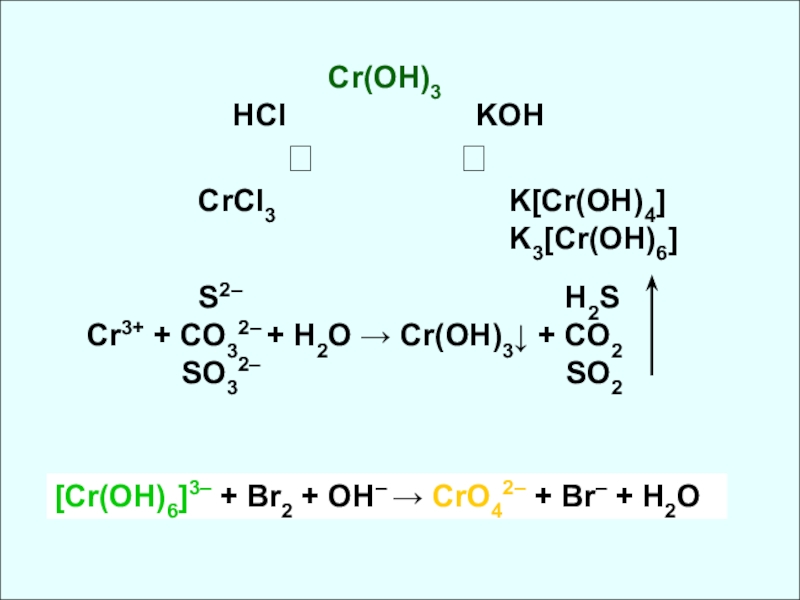
HCl KOH
⭩ ⭨
CrCl3 K[Cr(OH)4]
K3[Cr(OH)6]
S2– H2S
Cr3+ + CO32– + H2O → Cr(OH)3↓ + CO2
SO32– SO2
[Cr(OH)6]3– + Br2 + OH– → CrO42– + Br– + H2O
Слайд 20
CrIII
CrVI
Cr3+
[Cr(OH)6]3-
Cr2O72-
CrO42-
H+
H+
OH-
OH-
Схема переходов CrIII в CrVI в различных средах
+ восстановитель
+ окислитель
Слайд 21
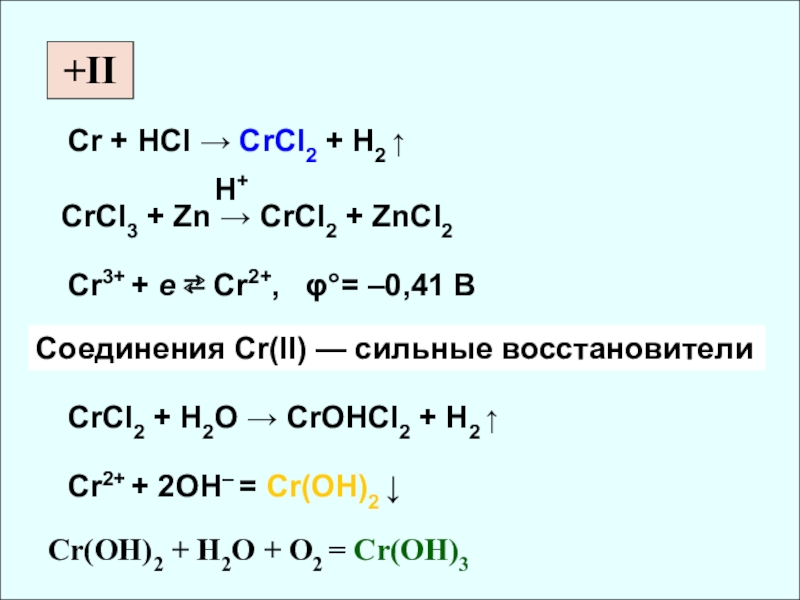
+II
Cr + HCl → CrCl2 + H2 ↑
CrCl3 + Zn →
Cr3+ + e ⇄ Cr2+, φ°= –0,41 B
Соединения Cr(II) — сильные восстановители
CrCl2 + H2O → CrOHCl2 + H2 ↑
Cr2+ + 2OH– = Cr(OH)2 ↓
Cr(OH)2 + H2O + O2 = Cr(OH)3
H+
Слайд 22
t
CrO3 + Al Cr + Al2O3
Получение хрома из
Основная область применения хрома – легирование железа для получения нержавеющей стали
Более подробное описание способов получения хрома и молибдена вы можете найти в дополнительных материалах к лекции № 12 на сайте кафедры
Слайд 23Дополнительный материал к лекции № 12
Хром, молибден, вольфрам*
*Производство вольфрама описано в
Слайд 24Хром
В металлургии для получения легированных сталей более выгодно использовать не чистый
Основная область применения хрома – это легирование сталей и сплавов. Стали, содержащие хром, подразделяются на хромистые, хромоникелевые (пластичные, коррозионноустойчивые); нержавеющие; инструментальные; жаростойкие и жаропрочные.
Также на основе добавок хрома получают термостойкие материалы, керметы.
Слайд 25Получение феррохрома
Для выплавки феррохрома применяют хромовую руду – хромистый железняк (FeO
Для выплавки углеродистого феррохрома в качестве восстановителя применяют коксик (С), для получения феррохрома с пониженным содержанием углерода восстановление ведут кремнием или алюминием.
В процессе плавки руды идет восстановление хрома, железа, кремния.
1/3Cr2O3 + C = 2/3Cr + CO - Q
1/3Cr2O3 + 9/7C = 2/21Cr7C3 + CO - Q
Температура плавки – 1600-1800 ºС. Железо также восстанавливается углеродом и растворяется в карбиде хрома.
карбид хрома
Слайд 26Содержание углерода в феррохроме может достигать 8 % - это так
В процессе плавки частично восстанавливается кремний, так что содержание кремния в феррохроме доходит до 2-5 %.
В феррохром переходит также часть фосфора и серы, вносимых с шихтой.
Восстановительные ферросплавные печи представляют собой мощные электродуговые печи сталеплавильного типа. Они работают в непрерывном режиме. Общий вид ферросплавной печи приведен в доп.материалах лекции № 11.
Для получения феррохрома с пониженным содержанием углерода (средне-, мало- и безуглеродистый феррохром) применяют силикотермический и алюмотермический способы, а также продувку кислородом жидкого углеродистого феррохрома с последующим вакуумированием.
Слайд 27Одновременно протекают реакции восстановления карбидов хрома и железа:
(Cr, Fe)хСу + хSi
При алюмотермическом способе оксид хрома восстанавливают алюминиевой крупкой по реакции:
Cr2O3 + 2Al = 2Cr + Al2O3
Таким образом, cредне- и малоуглеродистый феррохром содержит соответственно 1- 4 и 0,2 - 0,5 % C, безуглеродистый феррохром содержит 0,02 - 0,1 % C.
При силикотермическом способе хромовую руду восстанавливают кремнием по реакциям:
2/3Cr2O3 + Si = 4/3Cr + SiO2
2FeO + Si = 2Fe + SiO2
Обезуглероживание продувкой кислородом и вакуумированием ведут в конвертере. Вначале жидкий феррохром продувают кислородом при нормальном давлении, а затем при пониженном давлении (в вакууме).
Слайд 28Получение хрома
Получение металлического хрома из природного хромистого железняка осуществляют в несколько
Первая стадия– окислительное плавление хромита в щелочной среде.
4FeCr2O4 + 8Na2CO3 + 7O2 → 8Na2CrO4 + 2Fe2O3 + 8CO2↑
Вторая стадия – растворение полученного спека в кислой среде. При этом происходит перевод хромата в дихромат, а железо в форме частично гидратированного оксида остается в осадке.
2Na2CrO4 + 2H2SO4 = Na2Cr2O7 + 2 NaHSO4 + H2O
t
Третья стадия – восстановление хрома (VI) до хрома (III) (до Cr2O3).
Na2Cr2O7 + 2C → Cr2O3 + Na2CO3 + CO↑
t
Слайд 29Металлический хром получают электролизом растворов солей хрома (III) или алюмотермическим восстановлением
Cr2O3 + 2Al = Al2O3 + 2Cr
Полученный «технически чистый» хром дополнительно очищают перегонкой в вакууме или электролитическим путем.
Слайд 30Молибден
Молибденит (MoS2) – наиболее распространенный и промышленно важный минерал молибдена.
После обогащения
1. Окислительный обжиг молибденитовых концентратов
MoS2 + 3,5O2 MoO3 + 2SO2↑
500-600 ºC
Обжиг проводят в многоподовых печах или в печах кипящего слоя.
2. Возгонка триоксида молибдена
Возгонка или испарение MoO3 осуществляется с целью очистки триоксида молибдена. Температура возгонки – 900-1100 ºС. Возогнанный триоксид (огарок) имеет высокую чистоту (99,975 % MоО3).
Аппарат для возгонки – электрические печи непрерывного действия с вращающимся кольцевым подом.
Краткая технологическая схема получения молибдена
Слайд 313. Выщелачивание.
Огарок выщелачивают раствором аммиака. Выщелачивание проводят в стальных реакторах,
7MoO3 + 6NH3 + 3H2O = (NH4)6Mo7O24
4. Нейтрализация раствора
Раствор парамолибдата аммония нейтрализуют соляной кислотой до рН = 2-3 и выделяют осадок молибденовой кислоты.
(NH4)6Mo7O24 + 6HCl + 4H2O = 7H2MoO4↓ + 6NH4Cl
5. Термическое разложение молибденовой кислоты
Термолиз молибденовой кислоты протекает при температуре 450-500 ºС в барабанных печах непрерывного действия.
H2MoO4 → MoO3 + H2O↑
MoO3 - порошок бледно-зеленого цвета
Слайд 326. Получение порошков молибдена.
Наиболее распространен в промышленной практике способ восстановления MoO3
MoO3 + 3H2 ⇔ Mo + 3H2O
Реакция протекает в две стадии. Вторую стадию ведут при температуре 900-1100 ºС.
Молибден получают в виде порошка, который затем превращают в компактный металл методом порошковой металлургии.


![Презентация по химии на тему: Хром, молибден,вольфрам. 11 класс. Cr + H2SO4 (разб.) → СrSO4 + H2↑Mo + H2SO4 (конц.) Cr + H2SO4 (разб.) → СrSO4 + H2↑Mo + H2SO4 (конц.) → H4[MoO4SO4] + SO2↑+ H2O (MoO2SO4)](/img/thumbs/d4a33873b2ea0e51041db2b011e22887-800x.jpg)
![Презентация по химии на тему: Хром, молибден,вольфрам. 11 класс. Cr(OH)3 + H2SO4 = Cr2(SO4)3 + H2OCr(OH)3 + NaOH = Na[Cr(OH)4]тетрагидроксохромит Cr(OH)3 + H2SO4 = Cr2(SO4)3 + H2OCr(OH)3 + NaOH = Na[Cr(OH)4]тетрагидроксохромит натрияCr2O3 + NaOH = NaCrO2](/img/thumbs/fdb52e9438cab834917fd2c8b8905da8-800x.jpg)


![Презентация по химии на тему: Хром, молибден,вольфрам. 11 класс. Вольфрам. Изополисоединения. [H2W12O42]10-- паравольфрамат Б-ион; [H2W12O40]6-- метавольфрамат-ион[W7O24]6-- паравольфрамат А-ионNa2MoO4 —→ 3MoO3 Вольфрам. Изополисоединения. [H2W12O42]10-- паравольфрамат Б-ион; [H2W12O40]6-- метавольфрамат-ион[W7O24]6-- паравольфрамат А-ионNa2MoO4 —→ 3MoO3 • Mo2O5 • H2O ↓Молибденовые и](/img/thumbs/7bfab1785941994ea89b399c5a57b899-800x.jpg)

![Презентация по химии на тему: Хром, молибден,вольфрам. 11 класс. [Cr(H2O)6]3+ [Cr(H2O)5OH]2+ [Cr(H2O)6]3+ [Cr(H2O)5OH]2+](/img/thumbs/abd4c9a9f82128c513c0a4de9074fb2d-800x.jpg)
![Презентация по химии на тему: Хром, молибден,вольфрам. 11 класс. CrIIICrVICr3+[Cr(OH)6]3-Cr2O72-CrO42-H+H+OH-OH-Схема переходов CrIII в CrVI в различных средах+ восстановитель+ окислитель CrIIICrVICr3+[Cr(OH)6]3-Cr2O72-CrO42-H+H+OH-OH-Схема переходов CrIII в CrVI в различных средах+ восстановитель+ окислитель](/img/tmb/4/341504/e680b5dc7b56eb96e1c2a4a5ecdde98c-800x.jpg)