- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Хром и его соединения (11 класс)
Содержание
- 1. Презентация по химии на тему Хром и его соединения (11 класс)
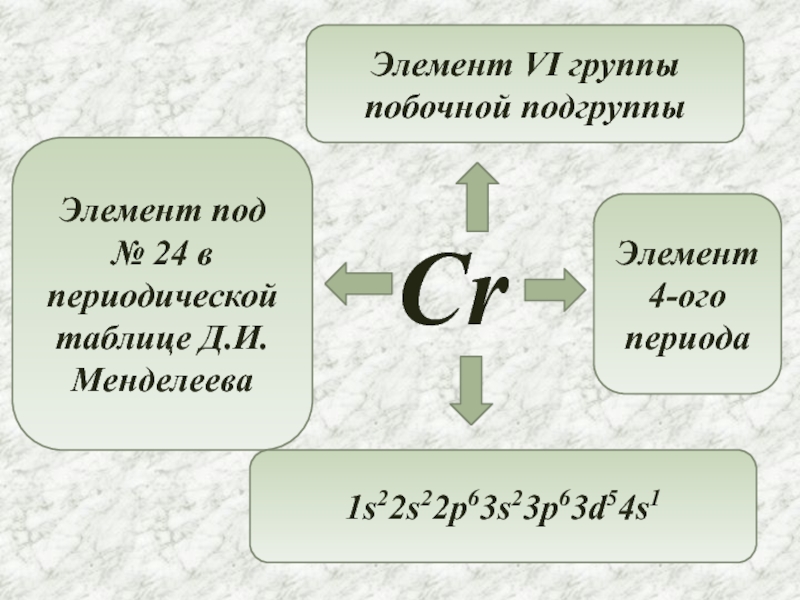
- 2. CrЭлемент под № 24 в периодической таблице Д.И.МенделееваЭлемент VI группы побочной подгруппы Элемент 4-ого периода1s22s22p63s23p63d54s1
- 3. Нахождение в природеХромистый железнякFeO* Cr2O3Хромит FeCr2O4КрокоитPbCrO4
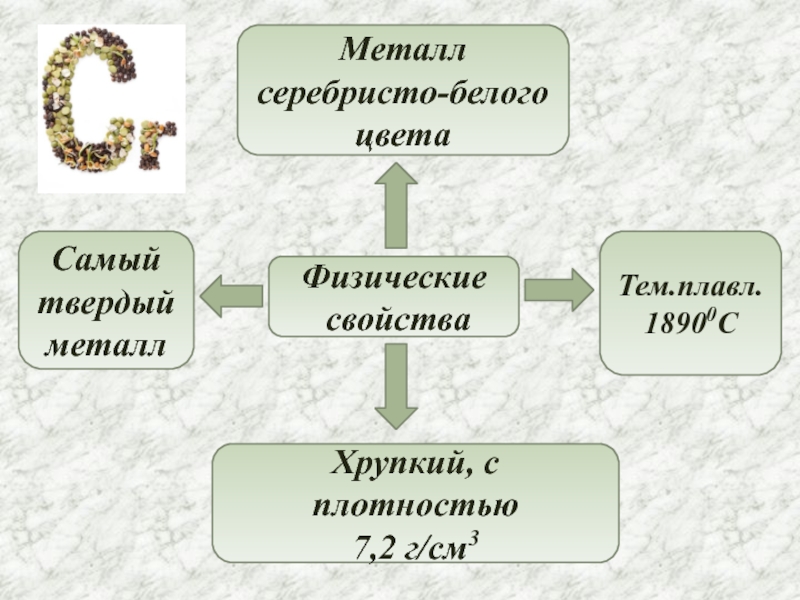
- 4. Физические свойстваМеталл серебристо-белого цветаСамый твердый металлХрупкий, с плотностью7,2 г/см3Тем.плавл.18900C
- 5. Химические свойства хрома1.Реагирует с неметаллами(при нагревании)А)4Cr +
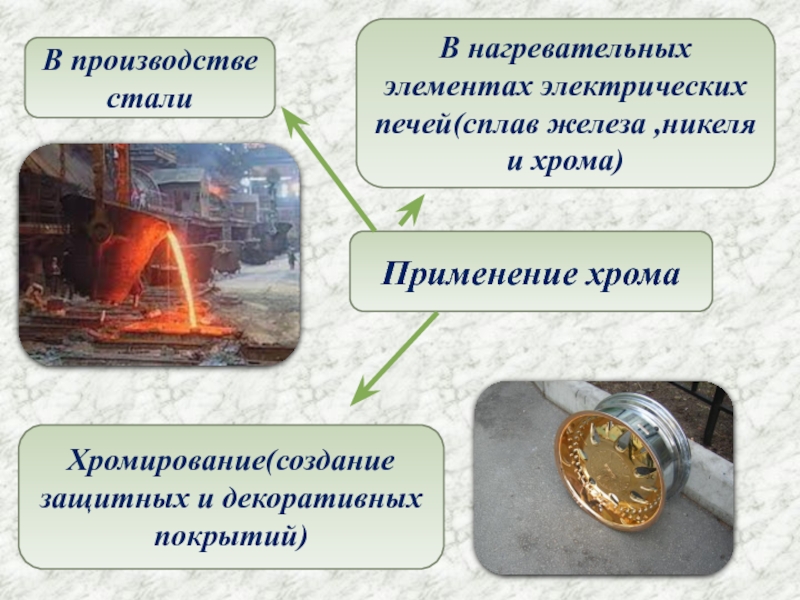
- 6. Применение хромаВ производстве сталиВ нагревательных элементах электрических печей(сплав железа ,никеля и хрома)Хромирование(создание защитных и декоративных покрытий)
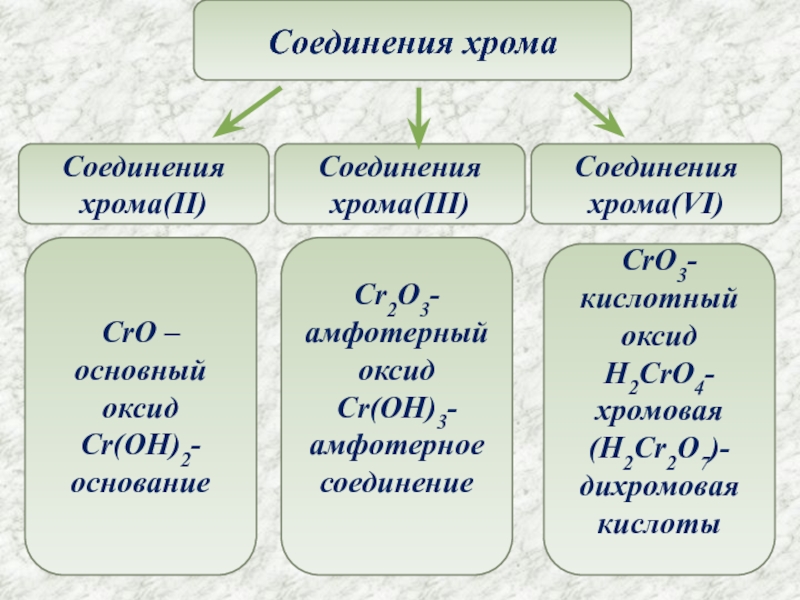
- 7. Соединения хромаСоединения хрома(II)Соединения хрома(III)Соединения хрома(VI)CrO –основный оксидCr(OH)2-основаниеCrO3-кислотный оксидH2CrO4-хромовая(H2Cr2O7)-дихромовая кислотыCr2O3-амфотерный оксидCr(OH)3-амфотерное соединение
- 8. Соединения хрома(II)1.Реагирует с кислотамиCrO+2HCL==CrCL2+H2O2.Окисляется кислородом воздуха4CrO + O2 =2Cr2O3При нагревании разлагаетсяCr(OH)2 =CrO + H2O2.Реагирует с кислотамиCr(OH)2+H2SO4==CrSO4+2H2O
- 9. Соединения хрома(III)Cr2O3 –при обычных условиях не реагирует
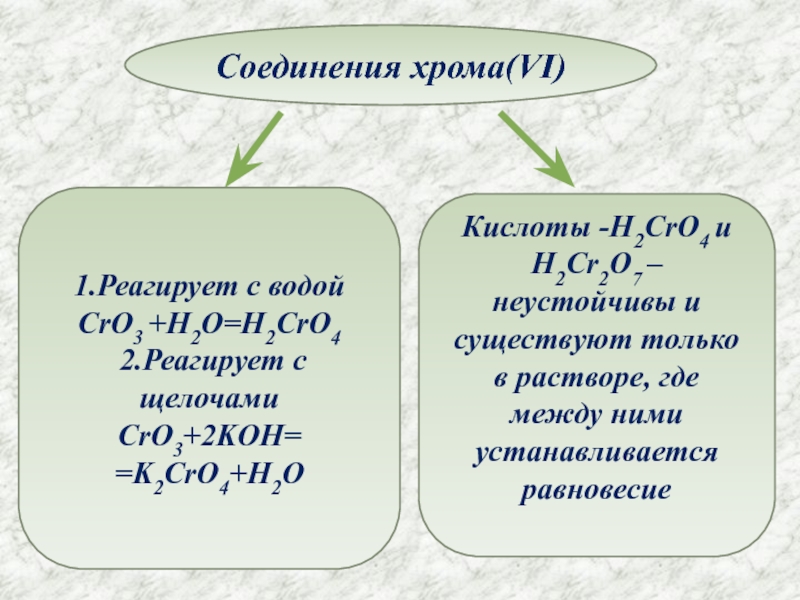
- 10. Соединения хрома(VI)1.Реагирует с водойCrO3 +H2O=H2CrO4 2.Реагирует с
- 11. Хроматы и дихроматыХромовая и дихромовая кислоты образуют
- 12. В кислой среде хроматы переходят в дихроматы,
- 13. Сульфат хрома и хромокалиевые квасцы используют для
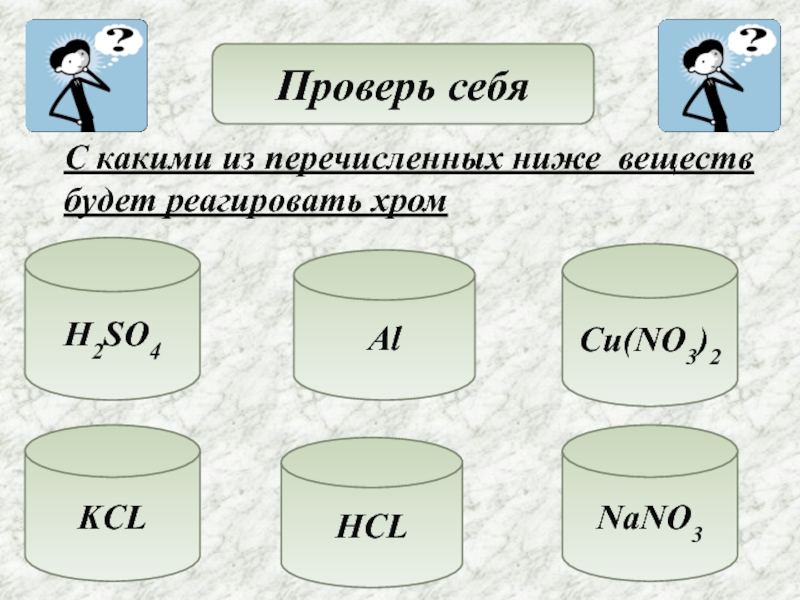
- 14. Проверь себяС какими из перечисленных ниже веществбудет реагировать хромH2SO4AlKCLHCLNaNO3Cu(NO3)2
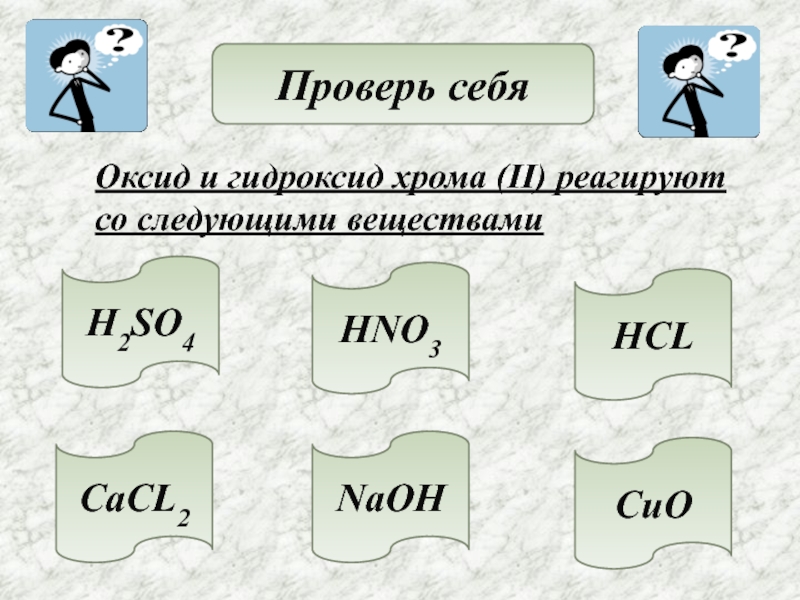
- 15. Проверь себяОксид и гидроксид хрома (II) реагируютсо следующими веществами H2SO4HNO3HCLCaCL2NaOHCuO
Слайд 2Cr
Элемент под
№ 24 в периодической таблице Д.И.Менделеева
Элемент VI группы побочной
Элемент 4-ого периода
1s22s22p63s23p63d54s1
Слайд 4Физические
свойства
Металл серебристо-белого цвета
Самый твердый металл
Хрупкий, с плотностью
7,2 г/см3
Тем.плавл.
18900C
Слайд 5Химические свойства хрома
1.Реагирует с неметаллами(при нагревании)
А)4Cr + 3O2 =2Cr2O3
Б)2Cr + N2
В)2Cr +3S = Cr2S3
2.Реагирует с парами воды(в раскаленном состоянии)
2Cr + 3H2O=Cr2O3 + 3H2
3.Реагирует с кислотами
Cr + H2SO4 = CrSO4 + H2
4.Реагирует с солями менее активных металлов
Cr + CuSO4 = CrSO4 + Cu
Слайд 6Применение хрома
В производстве стали
В нагревательных элементах электрических печей(сплав железа ,никеля и
Хромирование(создание
защитных и декоративных покрытий)
Слайд 7Соединения хрома
Соединения хрома(II)
Соединения хрома(III)
Соединения хрома(VI)
CrO –основный оксид
Cr(OH)2-
основание
CrO3-кислотный оксид
H2CrO4-хромовая
(H2Cr2O7)-дихромовая кислоты
Cr2O3-амфотерный оксид
Cr(OH)3-амфотерное соединение
Слайд 8Соединения хрома(II)
1.Реагирует с кислотами
CrO+2HCL=
=CrCL2+H2O
2.Окисляется кислородом воздуха
4CrO + O2 =2Cr2O3
При нагревании разлагается
Cr(OH)2
2.Реагирует с кислотами
Cr(OH)2+H2SO4=
=CrSO4+2H2O
Слайд 9Соединения хрома(III)
Cr2O3 –при обычных условиях не реагирует с растворами кислот и
Cr2O3 –реагирует лишь при сплавлении
Cr2O3+Ba(OH)2=
=Ba(CrO2)2+H2O
Реагирует с более активными металлами
Cr2O3 + 2Al= Al2O3 + 2Cr
1.Реагирует с кислотами
Cr(OH)3 + 3HCL=
=CrCL3 + 3 H2O
2.Реагирует с щелочами
Cr(OH)3+3NaOH=
=Na3(Cr(OH)6)
3.При нагревании разлагается
2Cr(OH)3=Cr2O3 + 3H2O
Слайд 10Соединения хрома(VI)
1.Реагирует с водой
CrO3 +H2O=H2CrO4
2.Реагирует с щелочами
CrO3+2KOH=
=K2CrO4+H2O
Кислоты -H2CrO4 и H2Cr2O7
Слайд 11Хроматы и дихроматы
Хромовая и дихромовая кислоты образуют устойчивые соли- хроматы и
Хроматы и их растворы имеют желтую окраску, а дихроматы- оранжевую.
Хромат- ионы CrO42- и дихромат-ионы Cr2O72- легко переходят друг в друга при изменении среды растворов.
Слайд 12В кислой среде хроматы переходят в дихроматы, желтая окраска переходит в
2 K2CrO4 + H2SO4= K2Cr2O7 +K2SO4 +H2O
В щелочной среде дихроматы переходят в хроматы, оранжевая окраска сменяется желтой
K2Cr2O7+2KOH=2K2CrO4+H2O
Слайд 13Сульфат хрома и хромокалиевые квасцы используют для изготовления прочной хромовой кожи
Соединения
Хромовую смесь используют для мытья химической посуды в лабораториях
Применение соединений хрома