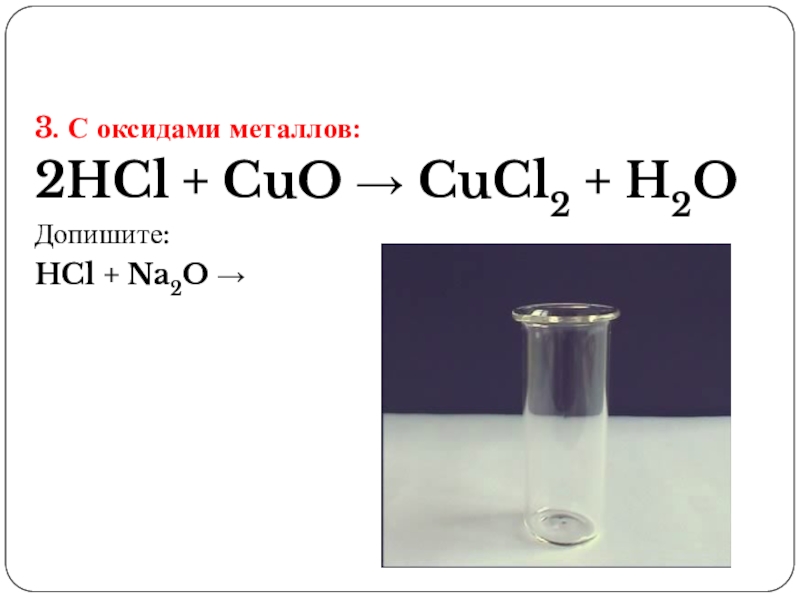- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Хлороводород.Соляная кислота
Содержание
- 1. Презентация по химии на тему Хлороводород.Соляная кислота
- 2. Галогеноводородные кислотыГалогеноводородные кислоты образуются при растворении галогеноводородов
- 3. Из всех галогеноводородов особенно большое значение имеют хлороводород и его раствор в воде — соляная кислота.
- 4. Хлороводород- HClБыл открыт в 1772г Д. ПристлиХимическая
- 5. Так, если заполненный хлороводородом цилиндр закрыть стеклянной
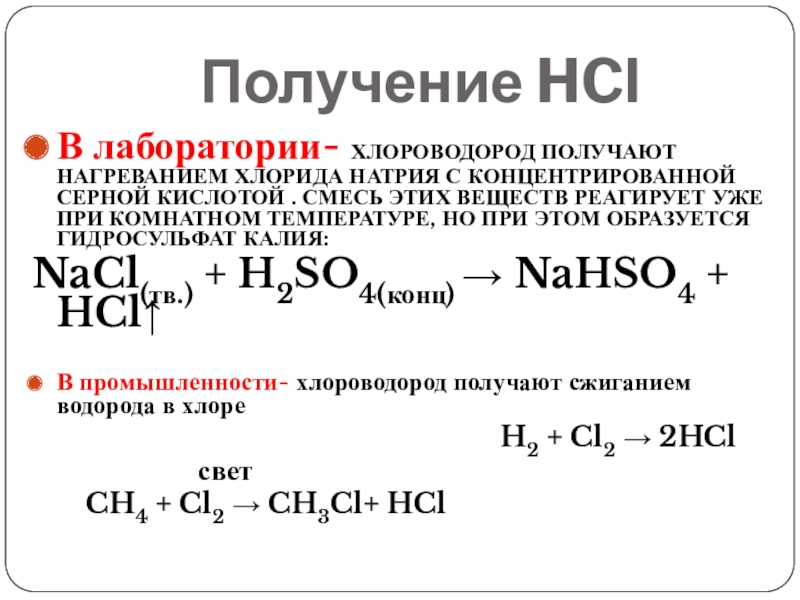
- 6. Получение HClВ лаборатории- хлороводород получают нагреванием хлорида
- 7. Опыт
- 8. Соляная кислота HCl Соляная кислота сильная,
- 9. 1.Взаимодействие индикаторов
- 10. Химические свойства2. Взаимодействие с металлами, стоящими в
- 11. 3. С оксидами металлов:2HCl + CuO → CuCl2 + H2OДопишите:HCl + Na2O →
- 12. 4. С гидроксидами металлов:HCl + NaOH → NaCl + H2OДопишите:HCl + Al(OH)3 →
- 13. 5. С солями (при условии, если образуется
- 14. Особые свойства Взаимодействие с окислителями:4HCl + MnO2
- 15. Тест по теме «Соляная кислота. Хлороводород» 1.Укажите
- 16. 3.Рассчитайте относительную плотность хлора и хлороводорода по
- 17. 4.Осадок образуется при взаимодействии соляной кислоты с
- 18. Домашнее заданиеП.48,49Упр.1,2 стр.169
Галогеноводородные кислотыГалогеноводородные кислоты образуются при растворении галогеноводородов в воде.Фтороводородная кислота ( плавиковая) HF.Хлороводородная кислота (соляная) HCl Бромоводородная кислота HBr. Йодоводородная кислота HI.Оксокислоты: Хлорная – НСlO4 Сl2O7 Хлорноватая – НСlO3 Сl2O5 Хлористая – НСlO2 Сl2O3 Хлорноватистая- НСlO Сl2O.
Слайд 2Галогеноводородные кислоты
Галогеноводородные кислоты образуются при растворении галогеноводородов в воде.
Фтороводородная кислота ( плавиковая) HF.
Хлороводородная кислота (соляная) HCl
Бромоводородная кислота HBr.
Йодоводородная кислота HI.
Оксокислоты:
Хлорная –
НСlO4 Сl2O7
Хлорноватая – НСlO3 Сl2O5
Хлористая – НСlO2 Сl2O3
Хлорноватистая- НСlO Сl2O.
Хлорноватая – НСlO3 Сl2O5
Хлористая – НСlO2 Сl2O3
Хлорноватистая- НСlO Сl2O.
Слайд 3Из всех галогеноводородов особенно большое значение имеют хлороводород и его раствор
в воде — соляная кислота.
Слайд 4Хлороводород- HCl
Был открыт в 1772г Д. Пристли
Химическая связь в молекуле
ковалентная, сильнополярная.
Хлороводород — бесцветный газ, немного тяжелее воздуха,
с резким запахом, во влажном воздухе дымит. (tплав =-1140С, tкип=-850С).
Наиболее характерным свойством хлороводорода является его большая растворимость в воде.
При О °С в одном объеме воды растворяется около 500 объемов газа.
Хлороводород — бесцветный газ, немного тяжелее воздуха,
с резким запахом, во влажном воздухе дымит. (tплав =-1140С, tкип=-850С).
Наиболее характерным свойством хлороводорода является его большая растворимость в воде.
При О °С в одном объеме воды растворяется около 500 объемов газа.
Слайд 5Так, если заполненный хлороводородом цилиндр закрыть стеклянной пластинкой, опрокинуть
вверх дном, внести в воду и пластинку убрать, то вода заполнит цилиндр.
В отличие от соляной кислоты хлороводород при обычных условиях не реагирует ни с металлами, ни с их оксидами.
В отличие от соляной кислоты хлороводород при обычных условиях не реагирует ни с металлами, ни с их оксидами.
Слайд 6Получение HCl
В лаборатории- хлороводород получают нагреванием хлорида натрия с концентрированной серной
кислотой . Смесь этих веществ реагирует уже при комнатном температуре, но при этом образуется гидросульфат калия:
NaCl(тв.) + H2SO4(конц) → NaHSO4 + HCl↑
В промышленности- хлороводород получают сжиганием водорода в хлоре
H2 + Cl2 → 2HCl
свет
CH4 + Cl2 → CH3Cl+ HCl
NaCl(тв.) + H2SO4(конц) → NaHSO4 + HCl↑
В промышленности- хлороводород получают сжиганием водорода в хлоре
H2 + Cl2 → 2HCl
свет
CH4 + Cl2 → CH3Cl+ HCl
Слайд 8Соляная кислота HCl
Соляная кислота сильная, т.е. в водных растворах
полностью распадается на ионы:
HCl → H+ + Cl-
Растворы кислоты не имеют запаха.
HCl → H+ + Cl-
Растворы кислоты не имеют запаха.
Слайд 10Химические свойства
2. Взаимодействие с металлами, стоящими в ряду активности до водорода:
2HCl
+ Zn → ZnCl2 + H2
Допишите:
HCl + Al →
Допишите:
HCl + Al →
Слайд 135. С солями (при условии, если образуется осадок или газ).
HCl +
AgNO3 → AgCl + HNO3
Нитрат серебра является реактивом на соляную кислоту и ее соли. При этом выпадает осадок белого цвета
Допишите:
HCl + СаCO3 →
Нитрат серебра является реактивом на соляную кислоту и ее соли. При этом выпадает осадок белого цвета
Допишите:
HCl + СаCO3 →
Слайд 14Особые свойства
Взаимодействие с окислителями:
4HCl + MnO2 → MnCl2 + Cl2
+ 2H2O
16HCl + 2KMnO4 → 2MnCl2 + 5Cl2 + 2KCl +8H2O
6HCl + KClO3 → 3Cl2 + KCl + 3H2O
16HCl + 2KMnO4 → 2MnCl2 + 5Cl2 + 2KCl +8H2O
6HCl + KClO3 → 3Cl2 + KCl + 3H2O
Слайд 15Тест по теме «Соляная кислота. Хлороводород»
1.Укажите группу веществ, в которой все
вещества реагируют с соляной кислотой:
А – цинк, гидроксид кальция, медь
Б – цинк, оксид меди, оксид кальция
В – оксид цинка, хлорид натрия, оксид калия
Г – кальций, углекислый газ, вода
2.Осадок не образуется при взаимодействии соляной кислоты с раствором:
А – нитрата серебра
Б – силиката калия
В – карбоната натрия
Г – нитрата свинца(2)
А – цинк, гидроксид кальция, медь
Б – цинк, оксид меди, оксид кальция
В – оксид цинка, хлорид натрия, оксид калия
Г – кальций, углекислый газ, вода
2.Осадок не образуется при взаимодействии соляной кислоты с раствором:
А – нитрата серебра
Б – силиката калия
В – карбоната натрия
Г – нитрата свинца(2)
Слайд 163.Рассчитайте относительную плотность хлора и хлороводорода по воздуху. Какой газ тяжелее?
А
– 2,44 и 1,258, хлор
Б – 3,44 и 2,258, хлор
В – 1,258 и 2,44, хлороводород
Г – 4 и 2,24 хлороводород
Б – 3,44 и 2,258, хлор
В – 1,258 и 2,44, хлороводород
Г – 4 и 2,24 хлороводород
Слайд 17
4.Осадок образуется при взаимодействии соляной кислоты с раствором:
А – нитрат серебра
Б
– нитрата цинка
В – нитрата натрия
Г – нитрата меди (2)
В – нитрата натрия
Г – нитрата меди (2)