- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Хлор. Хлориды
Содержание
- 1. Презентация по химии на тему Хлор. Хлориды
- 2. ГалогеныГалогены(«солероды») расположены в VII а подгруппе периодической
- 3. Поскольку на внешнем уровне атомов галогенов находится
- 4. Cl: 1s22s22p63s23p53d0 (валентность I),Cl*: 1s22s22p63s23p43d1 (валентность III),Cl**: 1s22s22p63s23p33d2 (валентность V),Cl***: 1s22s22p63s13p33d3 (валентность VII).
- 5. Степени окисления галогеновГалогены являются типичными неметаллами, проявляют
- 6. Химические свойства хлора1) Взаимодействие с водородом2) Взаимодействие
- 7. Химические свойства хлора3) взаимодействие с неметаллами4) взаимодействие
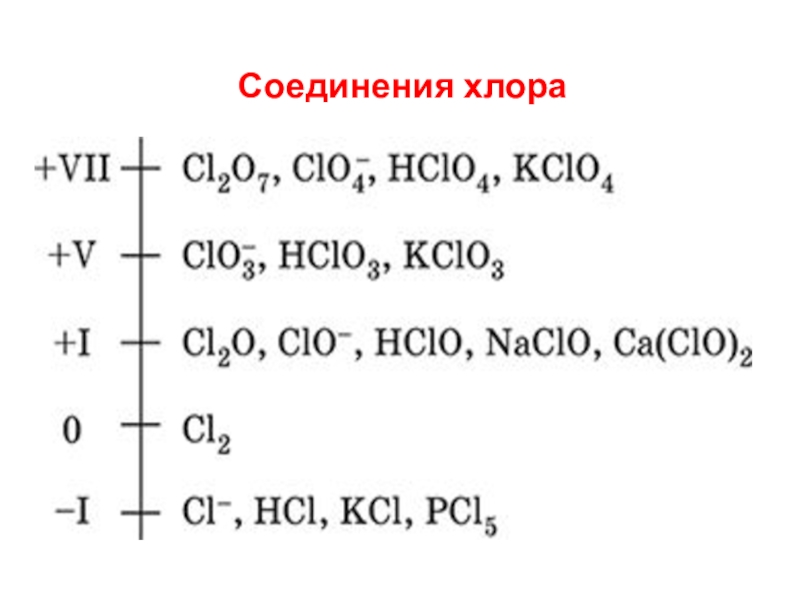
- 8. Соединения хлора
- 9. Среди наиболее распространенных соединений хлора можно выделить:
- 10. Соединения хлора
- 11. ХлороводородХлороводород (HCl) – бесцветный газ с резким запахом, тяжелее
- 12. Соляная кислотаВодный раствор хлороводорода называется соляной кислотой.
- 13. Свойства соляной кислотыHCl → H+ + Cl–,2HCl + Zn
- 14. Кислородсодержащие кислоты и их соли
- 15. Биологическое значение хлора и его соединений Галогены
- 16. В организме человека содержится около 100 г
- 17. Слайд 17
- 18. Основная форма поступления хлора в организм —
- 19. NaCl необходим для выработки соляной кислоты, которая
- 20. При недостаточном количестве соляной кислоты в желудке
- 21. Вывод:Хлор:Поддерживает нормальное осмотическое давление плазмы крови, лимфы,
- 22. Соляная кислота, входящая в состав желудочного сока человека,
- 23. Поваренная соль – это вещество, жизненно необходимое каждому
- 24. Слайд 24
- 25. Избыток хлора в организме является причиной заболеваний
- 26. Задания1) Осуществить превращение:Хлорид калия —> хлор —>
ГалогеныГалогены(«солероды») расположены в VII а подгруппе периодической системы. K ним относятся фтор, хлор, бром, йод и астат.
Слайд 1ГОСУДАРСТВЕННОЕ АВТОНОМНОЕ ПРОФЕССИОНАЛЬНОЕ УЧРЕЖДЕНИЕ
НОВОСИБИРСКОЙ ОБЛАСТИ
«БАРАБИНСКИЙ МЕДИЦИНСКИЙ КОЛЛЕДЖ»
Хлор. Хлориды
Автор: Дъячук Л.В.
Слайд 2Галогены
Галогены(«солероды») расположены в VII а подгруппе периодической системы.
K ним относятся
фтор, хлор, бром, йод и астат.
Слайд 3Поскольку на внешнем уровне атомов галогенов находится 1 неспаренный р-электрон, характерная валентность
равна I.
Kроме фтора, у атомов всех галогенов в возбужденном состоянии может увеличиваться число неспаренных электронов, поэтому возможны валентности III, V и VII.
Kроме фтора, у атомов всех галогенов в возбужденном состоянии может увеличиваться число неспаренных электронов, поэтому возможны валентности III, V и VII.
Слайд 4
Cl: 1s22s22p63s23p53d0 (валентность I),
Cl*: 1s22s22p63s23p43d1 (валентность III),
Cl**: 1s22s22p63s23p33d2 (валентность V),
Cl***: 1s22s22p63s13p33d3 (валентность VII).
Слайд 5Степени окисления галогенов
Галогены являются типичными неметаллами, проявляют окислительные свойства. Степень окисления
галогенов в соединениях с металлами и водородом –1; во всех кислородсодержащих соединениях галогены (кроме фтора) проявляют степени окисления +1, +3, +5, +7, например:
Слайд 6Химические свойства хлора
1) Взаимодействие с водородом
2) Взаимодействие с металлами
2Na + Cl2 = 2NaCl;
2Fe + 3Cl2 2FeCl3
2Fe + 3Cl2 2FeCl3
Слайд 7Химические свойства хлора
3) взаимодействие с неметаллами
4) взаимодействие с солями
2KBr +
Cl2 = 2KCl + Br2,
KCl + Br2 реакция не идет.
KCl + Br2 реакция не идет.
Слайд 9Среди наиболее распространенных соединений хлора можно выделить:
каменную или поваренную соль
(NaCl),
сильвинит (KCl•NaCl),
карналлит (KCl•MgCl2).
сильвинит (KCl•NaCl),
карналлит (KCl•MgCl2).
Слайд 11Хлороводород
Хлороводород (HCl) – бесцветный газ с резким запахом, тяжелее воздуха, хорошо растворим в
воде (в 1 объеме воды растворяется 450 объемов хлороводорода). Молекула образована по типу ковалентной полярной связи.
Слайд 12Соляная кислота
Водный раствор хлороводорода называется соляной кислотой. Kонцентрированная соляная кислота «дымит»
на воздухе, максимальная концентрация хлороводорода в растворе составляет 35–36 %. Это сильная кислота, проявляющая все характерные свойства кислот.
Слайд 13Свойства соляной кислоты
HCl → H+ + Cl–,
2HCl + Zn = ZnCl2 + H2 ,
HCl
+ Cu реакция не идет,
2HCl + CaO = CaCl2 + H2O,
HCl + NaOH = NaCl + H2O,
2HCl + Na2CO3 = 2NaCl + H2O + CO2 .
2HCl + CaO = CaCl2 + H2O,
HCl + NaOH = NaCl + H2O,
2HCl + Na2CO3 = 2NaCl + H2O + CO2 .
Слайд 15Биологическое значение хлора и его соединений
Галогены в виде различных соединений входят
в состав тканей человека и животных. Хлор и йод относятся к незаменимым элементам, а остальные являются постоянными составными частями тканей.
По содержанию в организме человека хлор (0,15%) относится к макроэлементам.
По содержанию в организме человека хлор (0,15%) относится к макроэлементам.
Слайд 16В организме человека содержится около 100 г (2790 ммоль) хлора.
Хлорид-ионы
играют важную биологическую роль:
они активируют некоторые ферменты, создают благоприятную среду для действия протолитических ферментов желудочного сока,
обеспечивают ионные потоки через клеточные мембраны,
участвуют в поддержании осмотического равновесия.
они активируют некоторые ферменты, создают благоприятную среду для действия протолитических ферментов желудочного сока,
обеспечивают ионные потоки через клеточные мембраны,
участвуют в поддержании осмотического равновесия.
Слайд 18Основная форма поступления хлора в организм — это хлорид натрия. Он
стимулирует обмен веществ, рост волос, придает бодрость и силу. Больше всего NаСl содержится в плазме крови.
Слайд 19NaCl необходим для выработки соляной кислоты, которая входит в состав желудочного
сока.
Без 0,2%-ной НСl практически прекращается процесс переваривания пищи.
Помимо важной роли соляной кислоты в процессе пищеварения, она уничтожает различные болезнетворные бактерии (холеры, тифа).
Без 0,2%-ной НСl практически прекращается процесс переваривания пищи.
Помимо важной роли соляной кислоты в процессе пищеварения, она уничтожает различные болезнетворные бактерии (холеры, тифа).
Слайд 20При недостаточном количестве соляной кислоты в желудке повышается рН и нарушается
нормальное пищеварение, что тяжело отражается на здоровье человека.
При пониженной кислотности желудочного сока в медицинской практике используют разбавленный раствор соляной кислоты. При воспалении желудка (гастрите), язвенной болезни секреция желудочного сока увеличивается, повышается его кислотность.
При пониженной кислотности желудочного сока в медицинской практике используют разбавленный раствор соляной кислоты. При воспалении желудка (гастрите), язвенной болезни секреция желудочного сока увеличивается, повышается его кислотность.
Слайд 21Вывод:
Хлор:
Поддерживает нормальное осмотическое давление плазмы крови, лимфы, спинномозговой жидкости.
Участвует в образовании
соляной кислоты, обмене веществ, построении тканей.
Необходим для дезинфекции клеток.
Способствует избавлению от лишнего веса.
Растворяет отложения на суставах.
Необходим для дезинфекции клеток.
Способствует избавлению от лишнего веса.
Растворяет отложения на суставах.
Слайд 22Соляная кислота, входящая в состав желудочного сока человека, выполняет ряд важных функций:
убивает
большую часть бактерий, попадающих в желудок вместе с пищей.
(например, холерный вибрион погибает в 0,5%-ной НСl)
0,5%-ная соляная кислота в желудке активизирует ферменты для переваривания белков.
(например, холерный вибрион погибает в 0,5%-ной НСl)
0,5%-ная соляная кислота в желудке активизирует ферменты для переваривания белков.
Слайд 23Поваренная соль – это вещество, жизненно необходимое каждому человеку:
в составе крови
у человека почти 0,9%хлорида натрия
0,9%-ный раствор NaСl называют физиологическим.
Но хлор должен поступать в организм ежедневно в количестве 3—6,6 г с растительной и животной пищей, а не в виде поваренной соли (хлорида натрия), ибо последняя приводит к защелачиванию организма, сгущает кровь и вызывает заболевания сердечнососудистой системы.
0,9%-ный раствор NaСl называют физиологическим.
Но хлор должен поступать в организм ежедневно в количестве 3—6,6 г с растительной и животной пищей, а не в виде поваренной соли (хлорида натрия), ибо последняя приводит к защелачиванию организма, сгущает кровь и вызывает заболевания сердечнососудистой системы.
Слайд 25Избыток хлора в организме является причиной заболеваний желудочно-кишечного тракта, головных болей,
нарушения общего обмена веществ.
Повышение его концентрации в крови наступает при обезвоживании организма, а также при нарушении выделительной функции почек
Повышение его концентрации в крови наступает при обезвоживании организма, а также при нарушении выделительной функции почек
Слайд 26Задания
1) Осуществить превращение:
Хлорид калия —> хлор —> хлороводород —> хлорид кальция
—> хлороводород —> хлор
2) Сосуд с 200 г хлорной воды выдержали на прямом солнечном свету и собрали выделившийся газ, объем которого при н.у. составил 0,18 л. Определите состав хлорной воды (массовую долю хлора).
2) Сосуд с 200 г хлорной воды выдержали на прямом солнечном свету и собрали выделившийся газ, объем которого при н.у. составил 0,18 л. Определите состав хлорной воды (массовую долю хлора).