- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Химическое равновесие
Содержание
- 1. Презентация по химии на тему Химическое равновесие
- 2. Некоторые понятия химической кинетики.Химическая кинетика – раздел
- 3. Что такое химические реакции? Химические реакции –
- 4. Химические реакции протекают с разными скоростями. Быстрые
- 5. Скорость гомогенной реакции определяется как изменение концентрации
- 6. Факторы, влияющие на скорость химической реакции.
- 7. В случае c HCl реакция пойдет быстрее,
- 8. Температура Правило Вант-Гоффа: Повышение температуры на каждые 10 °С
- 9. Пример 1: Если температурный коэффициент реакции равен
- 10. Концентрация реагирующих веществ Математически зависимость скорости от
- 11. Концентрация реагирующих веществ 2SO2 + О2 ⬄
- 12. Катализаторы Катализаторы – это вещества, участвующие в
- 13. Катализаторы 2SO2 + О2 ⬄ 2 SO3
- 14. Катализаторы Ферменты – биологически активныекатализаторы. Используются в
- 15. Площадь соприкосновения реагирующих веществВ каком случае реакция
- 16. Площадь соприкосновения реагирующих веществВ производстве серной кислоты
Слайд 2Некоторые понятия химической кинетики.
Химическая кинетика – раздел химии, изучаю-
щий скорость и
Гомогенные реакции – реакции, протекающие в однородной среде (в растворе или газовой фазе) во всем объеме реакционной смеси.
Гетерогенные реакции – реакции в неоднородных системах, как правило, благодаря участию твердого вещества. Реакция в таких системах протекает на границе раздела фаз.
Слайд 3Что такое химические реакции?
Химические реакции – превращения одних веществ в
Признаки химических реакций:
1) Выделяется газ; 2) Выпадет осадок;
3) Изменяется окраска веществ;
4) Выделяется или поглощается тепло, свет.
Слайд 4Химические реакции протекают с разными скоростями.
Быстрые реакции протекают в водных
Медленные реакции – разрушение горных пород, образование сталактитов и сталагмитов, коррозия металлов.
Слайд 5
Скорость гомогенной реакции определяется как изменение концентрации одного из веществ в
Скорость гетерогенной реакции определяется как изменение количества вещества в единицу времени на единице поверхности:
S — площадь поверхности соприкосновения веществ .
Как оценить скорость реакции?
Слайд 6Факторы, влияющие на скорость химической реакции.
Природа реагирующих веществ
Температура
Концентрация реагирующих веществ
Наличие катализатора
Площадь поверхности соприкосновения веществ
Слайд 7В случае c HCl реакция пойдет быстрее, т.к.
соляная кислота –
Природа реагирующих веществ
В каком случае реакция пойдет с бОльшей скоростью:
Zn + HCl ? или Zn + CH3COOH ?
Mg + HCl ? или Fe + HCl ?
В случае c Mg реакция пойдет быстрее, т.к.
магний более активный металл, чем железо.
Слайд 8Температура
Правило Вант-Гоффа:
Повышение температуры на каждые 10 °С
приводит к увеличению скорости
раза (эту величину называют температурным
коэффициентом реакции).
При повышении температуры резко повышается доля «активных» молекул, участвующих в эффективных соударениях, преодолевающих энергетический барьер реакции.
,
Вант-Гофф Якоб Хендрик
голландский химик, первая
Нобелевская премия по химии,
1901 г.
Слайд 9Пример 1: Если температурный коэффициент реакции равен 2, то при повышении
с 200С до 500С скорость реакции возрастет в 8 раз.
Температура
Пример 2: Если скорость реакции возросла в 243 раза, а температурный коэффициент реакции равен 3, то температура была повышена на 50 0С.
Слайд 10
Концентрация реагирующих веществ
Математически зависимость скорости от концентрации для реакции выражается
Т.е. скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коээфициентам.
СА, СВ – молярные концентрации веществ, k – константа скорости
Для реакции: аА + bВ = cАВ
Закон открыт в 1867 г. норвежскими
учеными К.Гульдбергом и П.Вааге
Слайд 11Концентрация реагирующих веществ
2SO2 + О2 ⬄ 2 SO3 + Q
Пример: Если в реакции
давление в системе увеличить в 2 раза, то скорость реакции возрастет в 8 раз.
Для реакций с участием газообразных веществ
повышение давления в системе или уменьшение объема
равносильно повышению концентрации
реагирующих веществ.
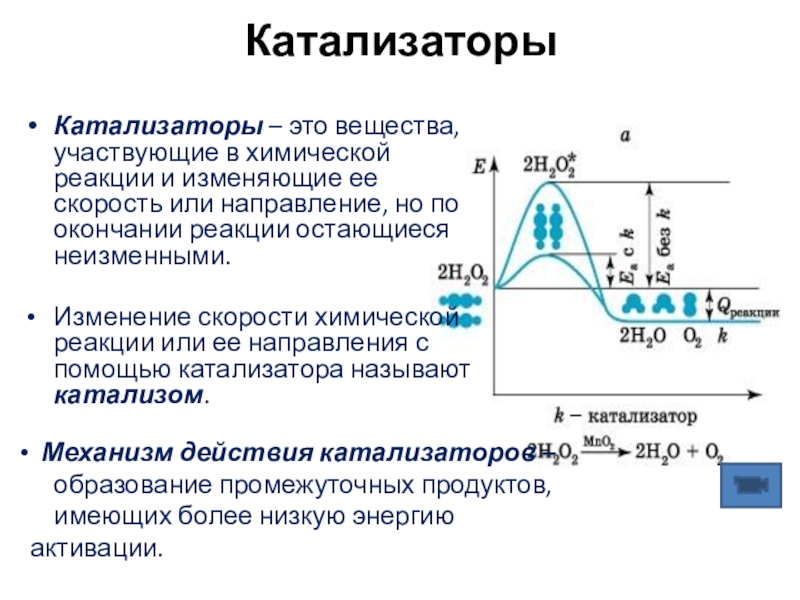
Слайд 12Катализаторы
Катализаторы – это вещества, участвующие в химической реакции и изменяющие
Изменение скорости химической реакции или ее направления с помощью катализатора называют катализом.
Механизм действия катализаторов –
образование промежуточных продуктов,
имеющих более низкую энергию активации.
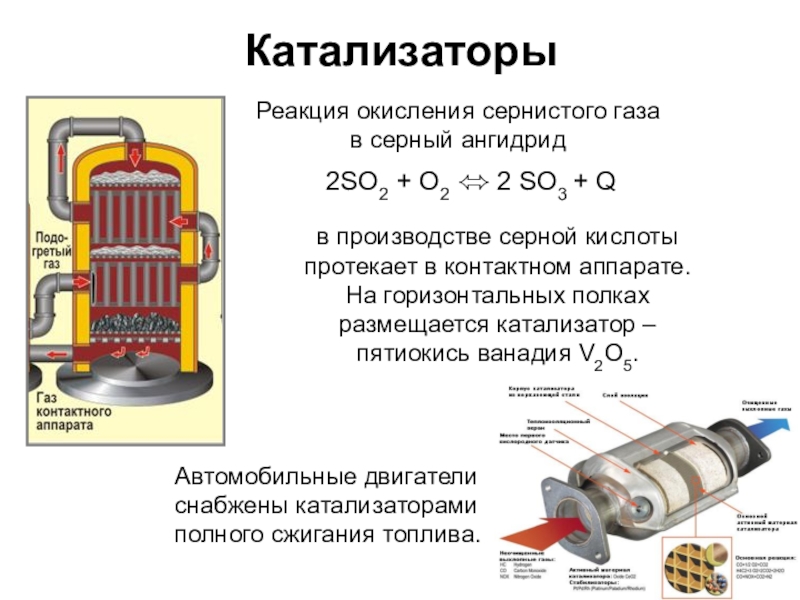
Слайд 13Катализаторы
2SO2 + О2 ⬄ 2 SO3 + Q
Реакция окисления
в серный ангидрид
в производстве серной кислоты
протекает в контактном аппарате.
На горизонтальных полках
размещается катализатор –
пятиокись ванадия V2O5.
Автомобильные двигатели
снабжены катализаторами
полного сжигания топлива.
Слайд 14Катализаторы
Ферменты – биологически активные
катализаторы.
Используются в производстве детского
питания, сыров,
виноделии и пивоварении.
Нежелательные реакции необходимо
замедлять. Для этого используют
вещества – ингибиторы.
Слайд 15Площадь соприкосновения реагирующих веществ
В каком случае реакция пойдет с бОльшей скоростью:
Feкусковое
С порошкообразным железом реакция пойдет быстрее, т.к. больше площадь поверхности соприкосновения реагирующих веществ.
Для гетерогенных реакций скорость не зависит
от количества твердого продукта реакции, а зависит
от степени его измельчения.
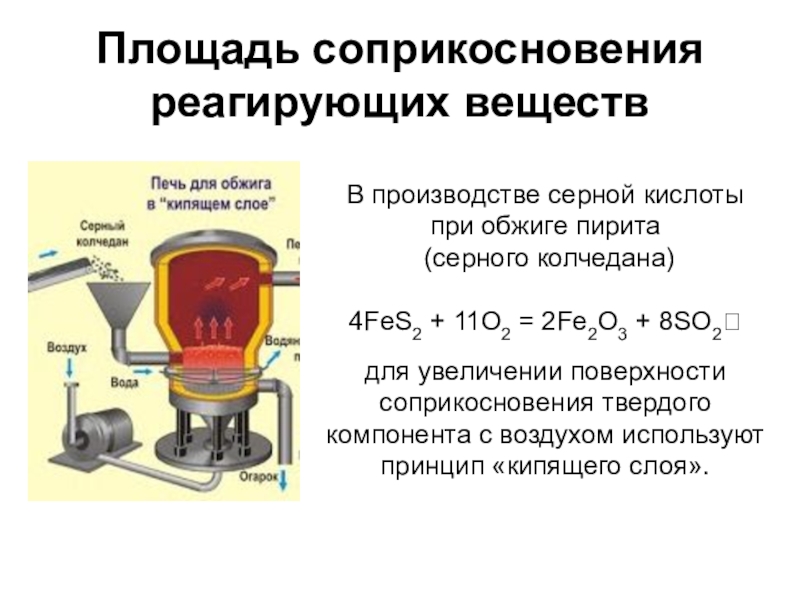
Слайд 16Площадь соприкосновения реагирующих веществ
В производстве серной кислоты
при обжиге пирита
(серного
4FeS2 + 11O2 = 2Fe2O3 + 8SO2?
для увеличении поверхности
соприкосновения твердого
компонента с воздухом используют
принцип «кипящего слоя».