- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Химические свойства воды. (8 класс)
Содержание
- 1. Презентация по химии на тему Химические свойства воды. (8 класс)
- 2. Вода даёт жизнь, но если она разгневается, то может забрать жизнь у всего живого.
- 3. Н2О Мr=18 Единственное вещество
- 4. 3/4 поверхности Земли покрыто водой
- 5. Вода в природе
- 6. ВОДАН2О Жидкость,Mr=18 без вкуса, без цвета, без запаха.ρ(Н2О)=1г/см3 при4°С,Ткип=100°С,Тпл=0°С (при р=1атм)
- 7. ЗАГРЯЗНИТЕЛИ ПРИРОДНЫХ ВОД
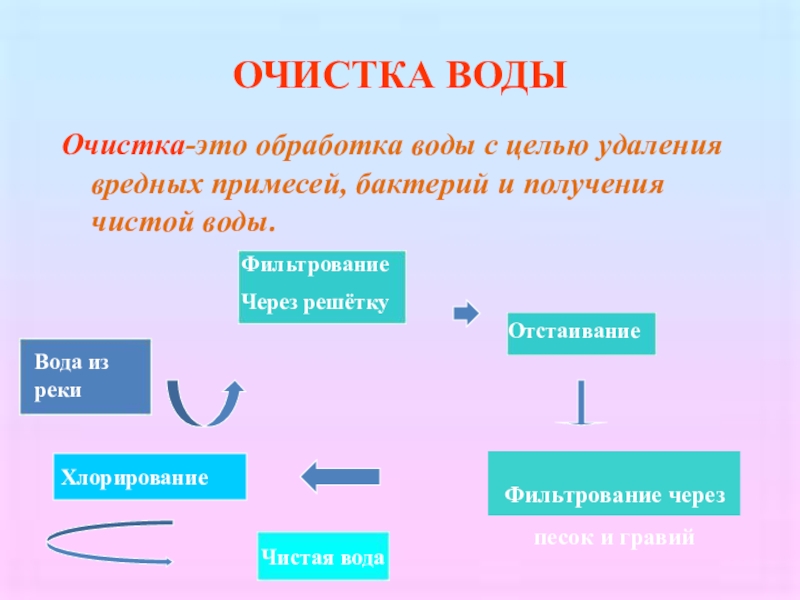
- 8. ОЧИСТКА ВОДЫОчистка-это обработка воды с целью удаления
- 9. Слайд 9
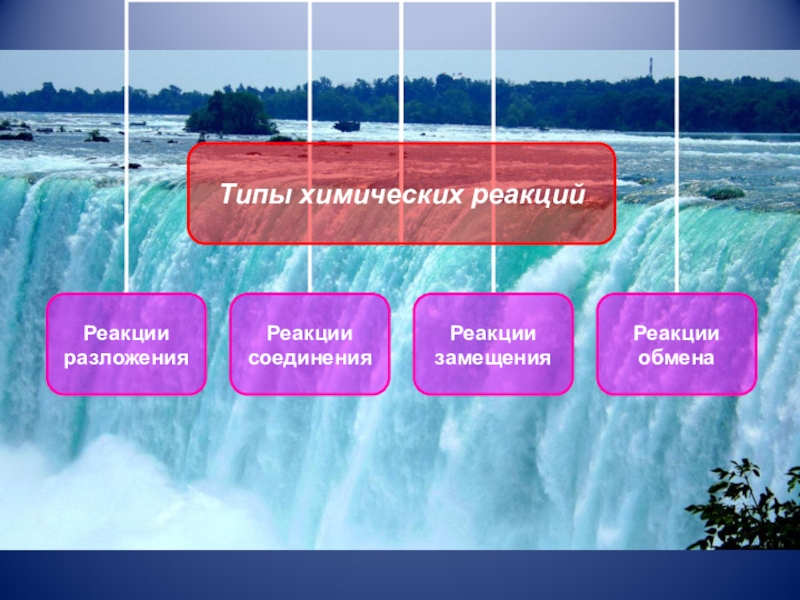
- 10. Н2ОТипы химических реакций на примере свойств воды
- 11. Слайд 11
- 12. Реакции соединения2Н2 + О2 → 2Н2О
- 13. Реакции разложения электрический токЭлектролиз воды
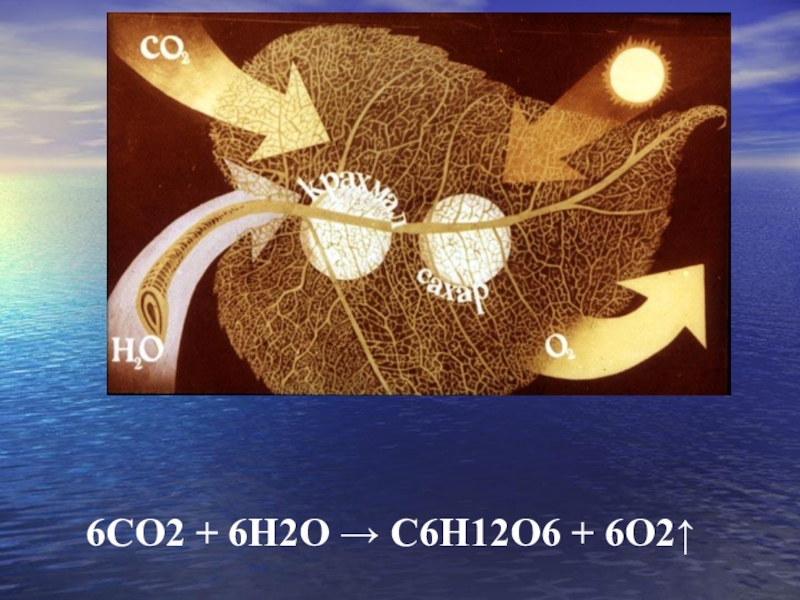
- 14. 6CО2 + 6Н2О → С6Н12О6 + 6О2↑
- 15. CaO + H2O =Ca(OH)2Реакция соединенияОпыт. Взаимодействие оксида кальция с водой
- 16. Реакции соединения N2O3 + H2O = N2O5
- 17. K + H2O = KOH + H2↑222 Реакции замещенияОпытОпыт. Взаимодействие калия с водой
- 18. CaC2 + H2O = C2H2 +
- 19. Выберите записи, представляющие собой только левую (1
- 20. Соотнесите:Типы химических реакций:1 вариант) соединения2 вариант) обменаУравнения реакцийА) 2H2+O2=2H2O,Б) NaOH+HCl=H2O+NaCl,В) Al2S3+6H2O=2Al(OH)3+3H2S,Г) BaO+H2O=Ba(OH)2
- 21. Соотнесите:Типы химических реакций:1вариант) разложения,2вариант) замещения.Уравнения реакций:А) 2H2O = 2H2+O2,Б) 2Fe(OH)3= Fe2O3+3H2O,В) 2K+2H2O=2KOH+H2,Г) Ca+2H2O =Ca(OH)2+H2.
- 22. Ответы:1 вариант:Б), В).А), Г).А), Б).2 вариант:А), Г).Б), В).В), Г).
- 23. Домашнее задание§ 33, упр.1,3 на стр.173
- 24. Типы химических реакций:соединениязамещенияобменаразложения
- 25. Вода используется в самых разных областях деятельности
- 26. Что мы узнали сегодня нового? Что было
- 27. Спасибо!
Слайд 1
Типы химических реакций
на примере свойств воды
Составила учительница химии
МКОУ Урадинская
Ахмедова З.С.
Слайд 3 Н2О
Мr=18 Единственное вещество в природе,
ВОДА
Слайд 6ВОДА
Н2О Жидкость,
Mr=18 без вкуса,
без цвета,
без запаха.
ρ(Н2О)=1г/см3 при4°С,
Ткип=100°С,Тпл=0°С (при р=1атм)
Слайд 8ОЧИСТКА ВОДЫ
Очистка-это обработка воды с целью удаления вредных примесей, бактерий и
Вода из реки
Фильтрование
Через решётку
Отстаивание
Хлорирование
Чистая вода
Фильтрование через песок и гравий
Слайд 16Реакции соединения
N2O3 + H2O =
N2O5 + H2O =
Но:
SiO2 + H2O
FeO + H2O =
HNO2
HNO3
2
2
+3
+5
гидроксиды- кислородсодержащие кислоты и основания
+3
+5
Слайд 18CaC2 + H2O = C2H2 + Ca(OH)2
2
Реакции обмена
Опыт. Взаимодействие карбида
Гидролиз – это обменное взаимодействие веществ с водой, приводящее к их разложению
Слайд 19Выберите записи, представляющие собой только левую (1 вариант) или только правую(2
А) = 2 H2 + O2
Б) CaO + H2O =
В) Cu(OH)2 =
Г) = 2NaCl +CO2+H2O
Слайд 20Соотнесите:
Типы химических реакций:
1 вариант) соединения
2 вариант) обмена
Уравнения реакций
А) 2H2+O2=2H2O,
Б) NaOH+HCl=H2O+NaCl,
В) Al2S3+6H2O=2Al(OH)3+3H2S,
Г)
Слайд 21Соотнесите:
Типы химических реакций:
1вариант) разложения,
2вариант) замещения.
Уравнения реакций:
А) 2H2O = 2H2+O2,
Б) 2Fe(OH)3= Fe2O3+3H2O,
В)
Г) Ca+2H2O =Ca(OH)2+H2.
Слайд 25Вода используется в самых разных областях деятельности человека. Без воды нет
Слайд 26Что мы узнали сегодня нового?
Что было непонятно?
Какие были
Что показалось самым интересным?
Что удивило вас?