ОШ» Кировского района Республики Крым
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Химические свойства солей
Содержание
- 1. Презентация по химии на тему Химические свойства солей
- 2. Установи соответствиеНитрат алюминия
- 3. Установи соответствиеНитрат алюминия
- 4. Установи соответствиеНитрат алюминия
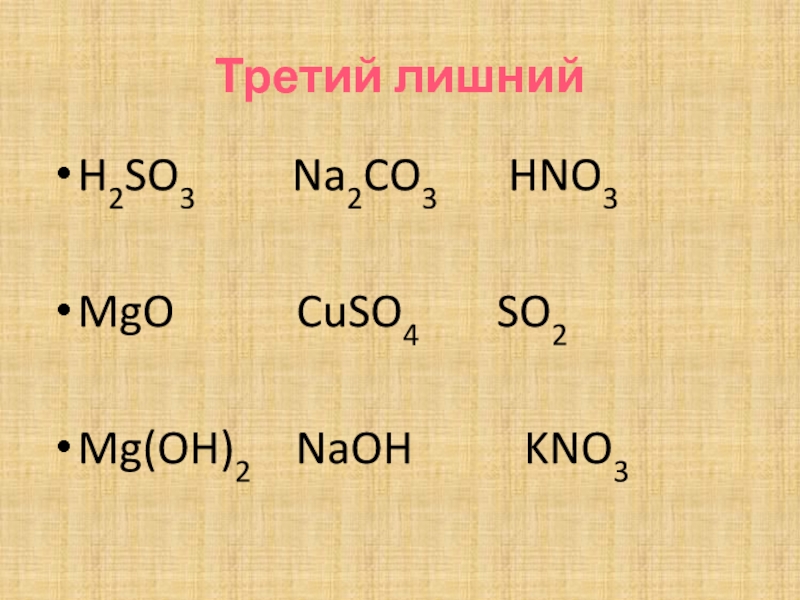
- 5. Третий лишнийH2SO3 Na2CO3
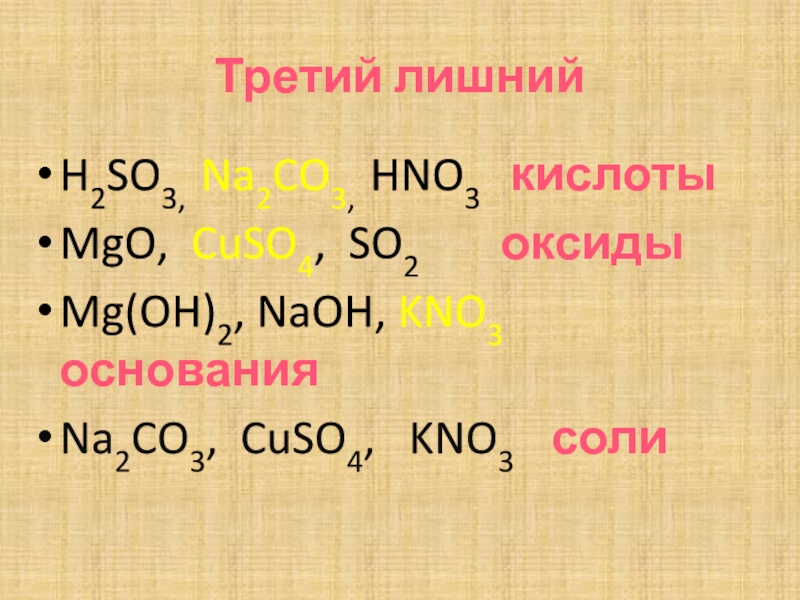
- 6. Третий лишнийH2SO3, Na2CO3, HNO3 кислотыMgO, CuSO4,
- 7. Самооценивание 1 по плануЯ знаю состав солей,
- 8. МотивацияЧто мы знаем о солях?Что ещё хотели бы узнать?Для чего вам нужны эти знания?
- 9. Тема урока: Химические свойства солейЦели урока: изучить
- 10. Домашнее задание§ 47, упр. 5 письменно – всем Упр. 2 письменно – на «4» и «5»
- 11. Методы:Химический эксперимент ( Соблюдаем ТБ)Сравнение
- 12. 1. Взаимодествие солей с металлами
- 13. 1. Взаимодествие солей с металламиCuSO4 +
- 14. ПрименениеМожно ли использовать оцинкованные ведра для хранения раствора медного купороса ?
- 15. Почему разрушаются памятники архитектуры?
- 16. 2. Взаимодействие солей с кислотами
- 17. 2. Взаимодействие солей с кислотами Na2CO3 + H2SO4 =
- 18. 2. Взаимодействие солей с кислотамиСоль1 + Кислота
- 19. ПрименениеНа каких химических свойствах основано применение питьевой
- 20. Применение
- 21. Применение
- 22. 3. Взаимодействие солей с щелочами CuSO4 + NaOH =
- 23. 3. Взаимодействие солей с щелочамиСоль1 + Щёлочь
- 24. 4. Взаимодействие солей с солямиBaCL2 + K2SO4 =
- 25. 4. Взаимодействие солей с солямиNa2CO3 + K2SO4 = Реакция не происходитНет признака реакции
- 26. 4. Взаимодействие солей с солямиСоль 1 +
- 27. Самооценивание 2 по плануЯ могу проводить эксперимент
- 28. Закрепление1. Соль 1 + Металл 1 =
- 29. Закрепление Соль 1 + Металл 1 =
- 30. Самооценивание 3 по плануЯ знаю с какими
- 31. Тема урока: Химические свойства солейЦели урока: изучить
- 32. Слайд 32
- 33. Слайд 33
Установи соответствиеНитрат алюминия - Al(NO3)3 Сульфат железа(II) - FeSO4Хлорид натрия
Слайд 1Химические свойства солей
Сейтумерова Татьяна Валентиновна, учитель химиии МБОУ «Владиславовская
Слайд 2Установи соответствие
Нитрат алюминия -
Al(NO3)3
Сульфат железа(II) - FeSO4
Хлорид натрия - NaCL
Фосфат калия - K3PO4
Сульфид железа(II) - FeS
Гидроксохлорид магния - Mg(OH)CL
Сульфат бария - BaSO4
Сульфат железа(II) - FeSO4
Хлорид натрия - NaCL
Фосфат калия - K3PO4
Сульфид железа(II) - FeS
Гидроксохлорид магния - Mg(OH)CL
Сульфат бария - BaSO4
Слайд 3Установи соответствие
Нитрат алюминия -
Al(NO3)3
Сульфат железа(II) - FeSO4
Хлорид натрия - NaCL
Фосфат калия - K3PO4
Сульфид железа(II) - FeS
Гидроксохлорид магния - Mg(OH)CL
Сульфат бария - BaSO4
Сульфат железа(II) - FeSO4
Хлорид натрия - NaCL
Фосфат калия - K3PO4
Сульфид железа(II) - FeS
Гидроксохлорид магния - Mg(OH)CL
Сульфат бария - BaSO4
Слайд 4Установи соответствие
Нитрат алюминия -
Al(NO3)3
Сульфат железа(II) - FeSO4
Хлорид натрия - NaCL
Фосфат калия - K3PO4
Сульфид железа(II) - FeS
Гидроксохлорид магния - Mg(OH)CL
Сульфат бария - BaSO4
Сульфат железа(II) - FeSO4
Хлорид натрия - NaCL
Фосфат калия - K3PO4
Сульфид железа(II) - FeS
Гидроксохлорид магния - Mg(OH)CL
Сульфат бария - BaSO4
Слайд 6Третий лишний
H2SO3, Na2CO3, HNO3 кислоты
MgO, CuSO4, SO2
оксиды
Mg(OH)2, NaOH, KNO3 основания
Na2CO3, CuSO4, KNO3 соли
Mg(OH)2, NaOH, KNO3 основания
Na2CO3, CuSO4, KNO3 соли
Слайд 7Самооценивание 1 по плану
Я знаю состав солей, их классификацию, могу находить
соли среди других соединений.
Я умею составлять формулы солей по валентности и давать названия по формулам.
Я знаю физические свойства и применение солей, умею пользоваться таблицей растворимости.
Выставь себе оценку: + + + = 5
Я умею составлять формулы солей по валентности и давать названия по формулам.
Я знаю физические свойства и применение солей, умею пользоваться таблицей растворимости.
Выставь себе оценку: + + + = 5
Слайд 9Тема урока: Химические свойства солей
Цели урока:
изучить основные химические свойства солей на
примерах взаимодействия солей с металлами, кислотами, щелочами, солями;
определить условия, при которых могут
протекать эти реакции;
узнать о значении некоторых реакций в повседневной жизни и для дальнейшего изучения химии
определить условия, при которых могут
протекать эти реакции;
узнать о значении некоторых реакций в повседневной жизни и для дальнейшего изучения химии
Слайд 131. Взаимодествие солей с металлами
CuSO4 + Fe
= FeSO4 + Cu
Соль 1 + Металл 1 = Соль 2 + Металл 2
Условие:
Более активный металл вытесняет менее активный из раствора его соли
Fe, Cu
Исключение:
Активные металлы (Li,Na,K,Ca,Ba) не применяют для таких опытов, т.к. они будут реагировать с водой.
Соль 1 + Металл 1 = Соль 2 + Металл 2
Условие:
Более активный металл вытесняет менее активный из раствора его соли
Fe, Cu
Исключение:
Активные металлы (Li,Na,K,Ca,Ba) не применяют для таких опытов, т.к. они будут реагировать с водой.
Слайд 182. Взаимодействие солей с кислотами
Соль1 + Кислота 1 = Соль
2 + Кислота 2
Условие:
Выделение газа
или
2. Выпадение осадка
Условие:
Выделение газа
или
2. Выпадение осадка
Слайд 19Применение
На каких химических свойствах основано применение питьевой соды?
При ожогах кислотой рекомендуется
промыть поражённое место водой, а затем наложить примочку с раствором питьевой соды. Почему?
Слайд 233. Взаимодействие солей с щелочами
Соль1 + Щёлочь = Соль 2
+ Основание
Условие:
Выпадение осадка
или
2. Выделение газа
Условие:
Выпадение осадка
или
2. Выделение газа
Слайд 264. Взаимодействие солей с солями
Соль 1 + Соль 2 =
Соль 3 + Соль 4
Условие:
Выпадение осадка
Применение
Условие:
Выпадение осадка
Применение
Слайд 27Самооценивание 2 по плану
Я могу проводить эксперимент и по признаку реакции
делать выводы
Я умею составлять уравнения реакций солей с металлами, кислотами, щелочами, солями.
Я знаю значение некоторых реакций в повседневной жизни.
Выставь себе оценку
Я умею составлять уравнения реакций солей с металлами, кислотами, щелочами, солями.
Я знаю значение некоторых реакций в повседневной жизни.
Выставь себе оценку
Слайд 28Закрепление
1. Соль 1 + Металл 1 = Соль 2 +
Металл 2
2. Соль 1 + Кислота 1 = Соль 2 + Кислота 2
3. Соль1 + Щёлочь = Соль 2 + Основание
4. Соль 1 + Соль 2 = Соль 3 + Соль 4
Условия реакций:
Исключи лишнее:
2. Соль 1 + Кислота 1 = Соль 2 + Кислота 2
3. Соль1 + Щёлочь = Соль 2 + Основание
4. Соль 1 + Соль 2 = Соль 3 + Соль 4
Условия реакций:
Исключи лишнее:
Слайд 29Закрепление
Соль 1 + Металл 1 = Соль 2 +
Металл 2
2. Соль 1 + Кислота 1 = Соль 2 + Кислота 2
3. Соль1 + Щёлочь = Соль 2 + Основание
4. Соль 1 + Соль 2 = Соль 3 + Соль 4
Исключи лишнее: 1 – реакция замещения
2, 3, 4, - реакции обмена
2. Соль 1 + Кислота 1 = Соль 2 + Кислота 2
3. Соль1 + Щёлочь = Соль 2 + Основание
4. Соль 1 + Соль 2 = Соль 3 + Соль 4
Исключи лишнее: 1 – реакция замещения
2, 3, 4, - реакции обмена
Слайд 30Самооценивание 3 по плану
Я знаю с какими веществами будут реагировать соли
и могу прогнозировать продукты реакции.
Я знаю условия протекания этих химических реакций.
Я могу определять типы химических реакций
Выставь себе оценку
Я знаю условия протекания этих химических реакций.
Я могу определять типы химических реакций
Выставь себе оценку
Слайд 31Тема урока: Химические свойства солей
Цели урока:
изучить основные химические свойства солей на
примерах взаимодействия солей с металлами, кислотами, щелочами, солями;
определить условия, при которых могут
протекать эти реакции;
узнать о значении некоторых реакций в повседневной жизни и для дальнейшего изучения химии
определить условия, при которых могут
протекать эти реакции;
узнать о значении некоторых реакций в повседневной жизни и для дальнейшего изучения химии