- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему ХИмические свойства неорганических соединений в свете ЭД и ОВР (9 класс)
Содержание
- 1. Презентация по химии на тему ХИмические свойства неорганических соединений в свете ЭД и ОВР (9 класс)
- 2. Девиз урока
- 3. Цель урокаПовторить химические свойства оксидов, кислот, оснований
- 4. Химические свойства оксидовВспомните, с какими веществами взаимодействуют
- 5. Химические свойства основных оксидовВзаимодействуют с кислотами
- 6. Химические свойства кислотных оксидов с растворимы основаниями
- 7. Химические свойства кислотВспомните, с какими веществами взаимодействуют кислоты ?с металламис основными оксидамис основаниямис солямиразлагаются при нагревании
- 8. с металлами 0
- 9. +1 -2 -1
- 10. Химические свойства основанийВспомните, с какими веществами взаимодействуют
- 11. Химические свойства основанийс кислотами +1 -2 +1
- 12. Химические свойства оснований3) Растворимые основания (щелочи) с
- 13. Химическая свойства солейВспомните, с какими веществами взаимодействуют
- 14. Химические свойства солейс металлами 0
- 15. Химические свойства солей3) с растворимыми основаниями (щелочами)
- 16. Химические свойства солей5) с кислотными оксидами
- 17. ГИА-9 (№22)Даны вещества: Mg, HNO3, Ba(NO3)2, HCl,
- 18. Самопроверка1) Mg + 2HCl = MgCl2 +
- 19. ГИА (№21)Какая масса осадка образуется при взаимодействии
- 20. Самопроверка Дано:mр-ра(Al2(SO4)3)= 200гω (Al2(SO4)3) =10,4% m( BaSO4
- 21. Домашнее заданиеПовторить химические свойства неорганических соединений,§9, зад.6Дополнительно для желающих (раздать карточки)
- 22. МОЛОДЦЫ!Вы успешно справились с работой!
- 23. Дополнительное д/з1) Бесцветный прозрачный раствор способен изменить
- 24. Дополнительное задание (ОГЭ-2020, №23)В трех колбах находятся
- 25. Правильный ответ1) определен реактив, необходимый для подтверждения
Слайд 1Химические свойства основных неорганических соединений
в свете ЭД и ОВР
9 класс
Учитель
первой квалификационной категории
Кукарева Зинаида Валентиновна
Слайд 3Цель урока
Повторить химические свойства оксидов, кислот, оснований , солей.
Рассмотреть уравнения реакций
Уметь писать полные и сокращенные уравнения реакций.
Слайд 4Химические свойства оксидов
Вспомните, с какими веществами взаимодействуют оксиды?
Основные оксиды
С кислотами
С водой
С
Кислотные оксиды
С растворимыми основаниями (щелочами)
С водой
С основными оксидами
Приведем примеры и рассмотрим в свете ЭД и ОВР
Слайд 5Химические свойства основных оксидов
Взаимодействуют с кислотами
+2 -2
CuO + H2SO4 = CuSO4 +H2O – не является ОВР
CuO + 2H+ + SO42- = Cu2+ + SO42- +H2O - РИО
CuO + 2H+ = Cu2+ +H2O
2) с водой
+1 -2 +1 -2 +1 -2 +1
Na2O + H2O = 2NaOH - не является ОВР и не РИО
3) с кислотными оксидами
+2 -2 +4 -2 +2 +4 -2
CaO + CO2 = CaCO3 - не является ОВР и не РИО
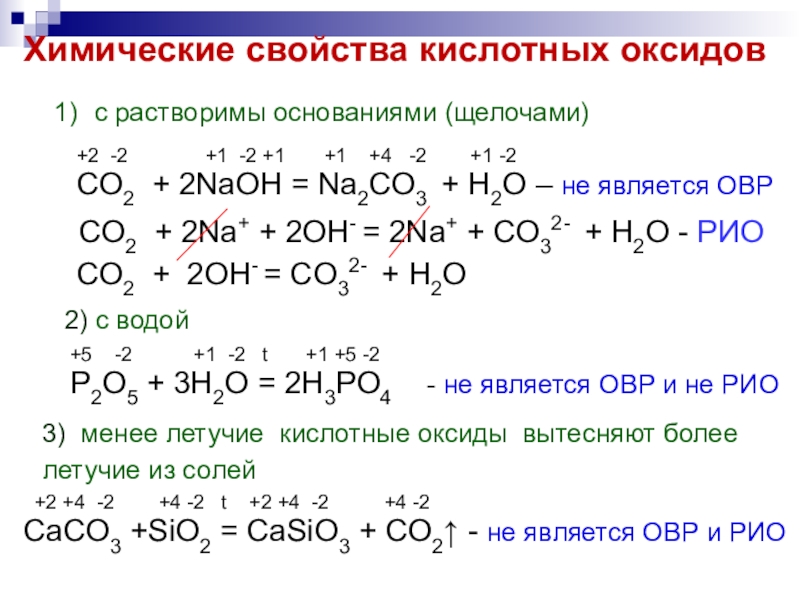
Слайд 6Химические свойства кислотных оксидов
с растворимы основаниями (щелочами)
+2 -2
CO2 + 2NaOH = Na2CO3 + H2O – не является ОВР
CO2 + 2Na+ + 2OH- = 2Na+ + CO32- + H2O - РИО
CO2 + 2OH- = CO32- + H2O
2) с водой
+5 -2 +1 -2 t +1 +5 -2
Р2O5 + 3H2O = 2H3PO4 - не является ОВР и не РИО
3) менее летучие кислотные оксиды вытесняют более летучие из солей
+2 +4 -2 +4 -2 t +2 +4 -2 +4 -2
CaCO3 +SiO2 = CaSiO3 + CO2↑ - не является ОВР и РИО
Слайд 7Химические свойства кислот
Вспомните, с какими веществами взаимодействуют кислоты ?
с металлами
с основными
с основаниями
с солями
разлагаются при нагревании
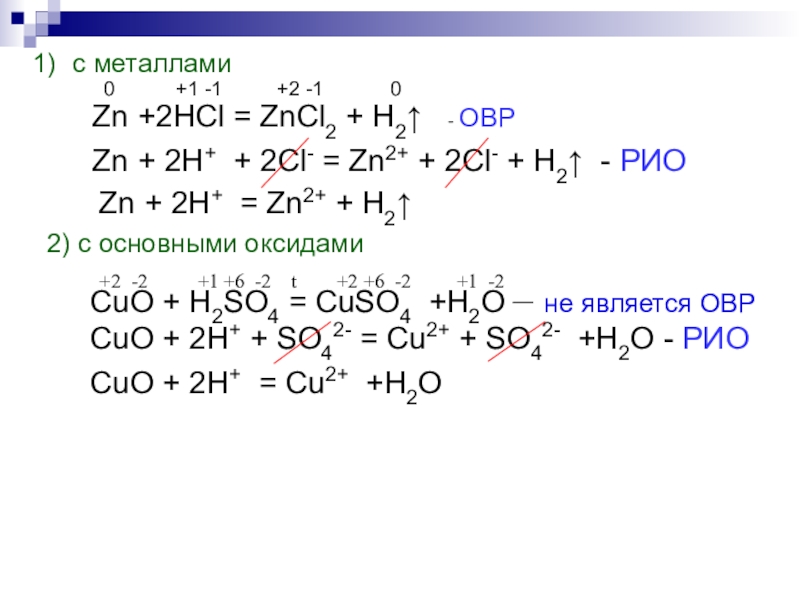
Слайд 8
с металлами
0 +1 -1
Zn +2HCl = ZnCl2 + H2↑ - ОВР
Zn + 2H+ + 2Cl- = Zn2+ + 2Cl- + H2↑ - РИО
Zn + 2H+ = Zn2+ + H2↑
2) с основными оксидами
+2 -2 +1 +6 -2 t +2 +6 -2 +1 -2
CuO + H2SO4 = CuSO4 +H2O – не является ОВР
CuO + 2H+ + SO42- = Cu2+ + SO42- +H2O - РИО
CuO + 2H+ = Cu2+ +H2O
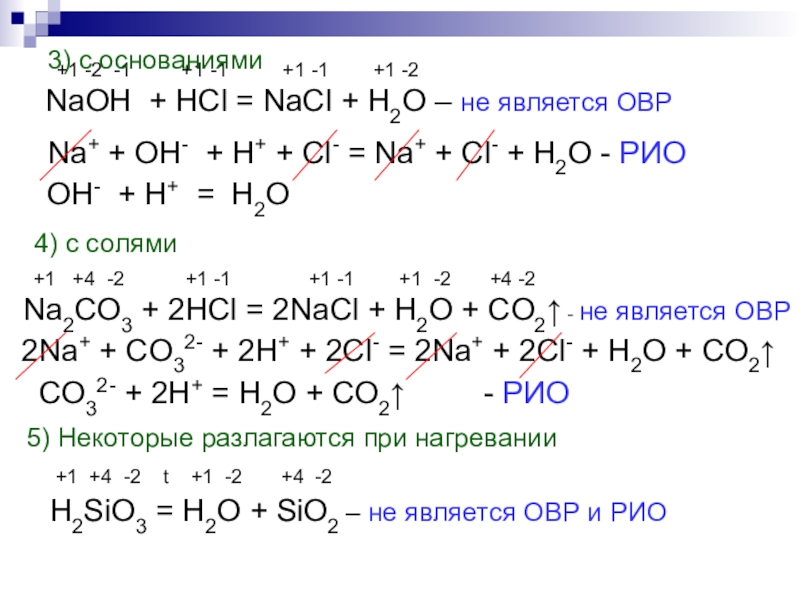
Слайд 9 +1 -2 -1 +1 -1
3) с основаниями
Na+ + OH- + H+ + Cl- = Na+ + Cl- + H2O - РИО
OH- + H+ = H2O
4) с солями
+1 +4 -2 +1 -1 +1 -1 +1 -2 +4 -2
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ - не является ОВР
2Na+ + CO32- + 2H+ + 2Cl- = 2Na+ + 2Cl- + H2O + CO2↑
CO32- + 2H+ = H2O + CO2↑ - РИО
5) Некоторые разлагаются при нагревании
+1 +4 -2 t +1 -2 +4 -2
H2SiO3 = H2O + SiO2 – не является ОВР и РИО
Слайд 10Химические свойства оснований
Вспомните, с какими веществами взаимодействуют основания?
с кислотами
растворимые основания (щелочи)
Растворимые основания (щелочи) с кислотными оксидами
нерастворимые разлагаются при нагревании
Слайд 11Химические свойства оснований
с кислотами
+1 -2 +1 +1
2КOH + H2SO4 = K2SO4 +2H2O - не является ОВР
2К+ + 2OH- + 2H+ + SO42- =2K+ + SO42- +2H2O - РИО
2OH- + 2H+ = 2H2O
2) растворимые основания (щелочи) с растворами солей
+1 -2 +1 +2 +6 -2 +1 +6 -2 +2 -2 +1
2КOH+ CuSO4 = K2SO4 + Cu(OH)2↓ - не является ОВР
2К+ +2OH- + Cu2+ +SO42- = 2K+ +SO42- +Cu(OH)2↓ - РИО
2OH- + Cu2+ = Cu(OH)2↓
Слайд 12Химические свойства оснований
3) Растворимые основания (щелочи) с кислотными оксидами
+1 -2
2КOH+ SO3= K2SO4 +H2O - не является ОВР
2К+ + 2OH- + SO3= 2K+ + SO42- + H2O - РИО
2OH- + SO3= SO42- + H2O
4) нерастворимые разлагаются при нагревании
+2 -2 +1 t +2 -2 +1 -2
Сu(OH)2 = CuO + H2O – не является ОВР и РИО
Слайд 13Химическая свойства солей
Вспомните, с какими веществами взаимодействуют соли?
с металлами
с кислотами
с растворимыми
с растворами солей
нерастворимые при нагревании разлагаются
Слайд 14Химические свойства солей
с металлами
0
Fe + CuSO4 = FeSO4 + Cu - ОВР
Fe + Cu2+ + SO42- = Fe2+ + SO42- + Cu - РИО
Fe + Cu2+ = Fe2+ + Cu
2) с кислотами
+1 +4 -2 +1 -1 +1 -1 +1 +4 -2
Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓ - не является ОВР
2Na+ +SiO32- +2H+ + 2Cl- = 2Na+ + 2Cl- +H2SiO3↓ - РИО
SiO32- + 2H+ = H2SiO3↓
Слайд 15Химические свойства солей
3) с растворимыми основаниями (щелочами)
+2 -1
ZnCl2 + 2KOH = 2KCl + Zn(OH)2↓ -не является ОВР
Zn2+ + 2Cl- + 2K+ +2OH- = 2K+ + 2Cl- + Zn(OH)2↓ - РИО
Zn2+ + 2OH- = Zn(OH)2↓
4) с растворами солей
+1 +5 -2 +1 -1 +1 +5 -2 +1 -1
AgNO3 + NaCl = NaNO3 + AgCl↓ - не является ОВР
Ag+ + NO3- +Na+ +Cl- =Na+ +NO3- +AgCl↓- РИО
Ag+ + Cl- = AgCl↓
Слайд 16Химические свойства солей
5) с кислотными оксидами
+2 +4 -2
CaCO3 +SiO2 = CaSiO3 + CO2↑ - не является ОВР и РИО
6) нерастворимые при нагревании разлагаются
+2 +4 -2 +2 -2 +4 -2
СaCO3 = CaO + CO2↑ - не является ОВР и РИО
Слайд 17ГИА-9 (№22)
Даны вещества: Mg, HNO3, Ba(NO3)2, HCl, AgNO3 . Используя воду
Слайд 18Самопроверка
1) Mg + 2HCl = MgCl2 + H2↑
2) MgCl2 + 2
Mg2+ +2Cl- +2Ag+ +2NO3- =Mg2+ +2NO3- +2AgCl↓
2Cl- + 2 Ag+ = 2AgCl↓
Слайд 19ГИА (№21)
Какая масса осадка образуется при взаимодействии избытка раствора хлорида бария
Запишите подробное решение задачи и ответ.
Слайд 20Самопроверка
Дано:
mр-ра(Al2(SO4)3)= 200г
ω (Al2(SO4)3) =10,4%
m( BaSO4 ) - ?
Решение:
Al2(SO4)3 +
1) m= mр-ра · ω = 200 г · 0,104 = 20,8 г (Al2(SO4)3)
20,8 г х г
2) М(Al2(SO4)3)= 27·2 +32·3+16·12=54+96+192= 342г/моль
3) М(BaSO4)= 137+ 32+16·4= 137+32+64 = 233г/моль
342 г 699г
4) 342 г – 699 г 20,8 г · 699 г
20,8 г – х г х= _____________= 42,5 г
342 г
Ответ: m(BaSO4)=42,5 г
Слайд 21Домашнее задание
Повторить химические свойства неорганических соединений,
§9, зад.6
Дополнительно для желающих (раздать карточки)
Слайд 23Дополнительное д/з
1) Бесцветный прозрачный раствор способен изменить окраску фенолфталеина на малиновую.
Слайд 24Дополнительное задание (ОГЭ-2020, №23)
В трех колбах находятся растворы веществ: хлорида железа
1) назовите два реактива необходимые для подтверждения наличия в растворе именно сульфата магния. Сформулируйте обоснование своего выбора.
2) составьте уравнения реакций, которые позволяют подтвердить наличие каждого из ионов в составе раствора сульфата магния.
Слайд 25Правильный ответ
1) определен реактив, необходимый для подтверждения наличия в выданном растворе
MgSO4 + BaCl2 = BaSO4 + MgCl2 (1б) 3) определен реактив, необходимый для подтверждения наличия в выданном растворе иона магния, и сформулировано обоснование выбора этого реактива, например: для подтверждения наличия в растворе иона магния можно использовать раствор гидроксида натрия (NaOH), т.к. при взаимодействии иона магния с гидроксид- ионом образуется нерастворимый осадок гидроксида магния (Mg(OH)2). (1б) 4) составлено уравнение реакции, которое позволяет подтвердить наличие иона магния в растворе сульфата магния:
MgSO4 + 2NaOH = Mg(OH)2 + Na2SO4 (1б)