- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Химические уравнения
Содержание
- 1. Презентация по химии на тему Химические уравнения
- 2. Тема:
- 3. Вспомним !Что такое вещество?Чем вещества отличаются друг
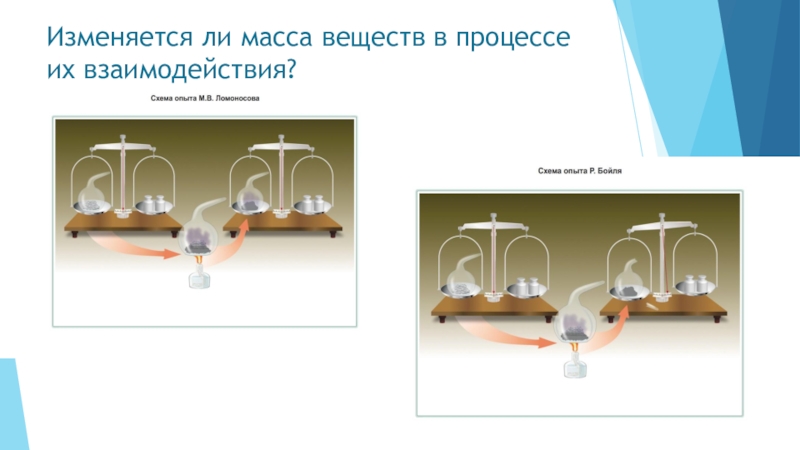
- 4. Как вы думаете, изменяется ли масса веществ в процессе их взаимодействия?
- 5. Изменяется ли масса веществ в процессе их взаимодействия?
- 6. Бойль проделал множество опытов по прокаливанию металлов
- 7. Подобно Бойлю русский учёный делал опыт в
- 8. Спустя 41 год после опытов Ломоносова французский
- 9. Почему масса веществ в процессе реакции сохраняется?
- 10. Вывод:сохранение массы объясняется тем, что атомы в
- 11. Как на письме отразить данный процесс –
- 12. Составление химических уравнений1.
- 13. Закрепление 1. Расставить коэффициенты в химической реакции
- 14. Анкета На уроке я работал
- 15. Домашнее задание§ 27, упр. 1-3
Слайд 1В течение тысячелетий люди верили в то, что вещество может бесследно
Слайд 2Тема:
Химические уравнения
Цель урока:
Опытным путем
Слайд 3Вспомним !
Что такое вещество?
Чем вещества отличаются друг от друга?
Какие признаки количественно
Какие изменения могут происходить с веществами?
Как определить, что произошла химическая реакция?
В чем заключается особенность химических реакций?
Слайд 6Бойль проделал множество опытов по прокаливанию металлов в запаянных ретортах и
Вот что записал учёный после одного из своих опытов в 1673 году.
«После двух часов нагревания был открыт запаянный кончик реторты, причём в неё ворвался с шумом наружный воздух.
По нашему наблюдению при этой операции была прибыль в весе на 8 гранов…»
Слайд 7Подобно Бойлю русский учёный делал опыт в запаянных ретортах. Но, в
В 1748 году М.В.Ломоносов сформулировал закон сохранения массы веществ.
В 1756 году Ломоносову удалось проверить опытным путём теоретически открытый закон сохранения массы вещества при химических реакциях.
Слайд 8Спустя 41 год после опытов Ломоносова французский учёный Антуан Лоран Лавуазье
Закон сохранения массы веществ:
масса веществ, вступивших в реакцию, равна массе веществ, полученных в результате реакции
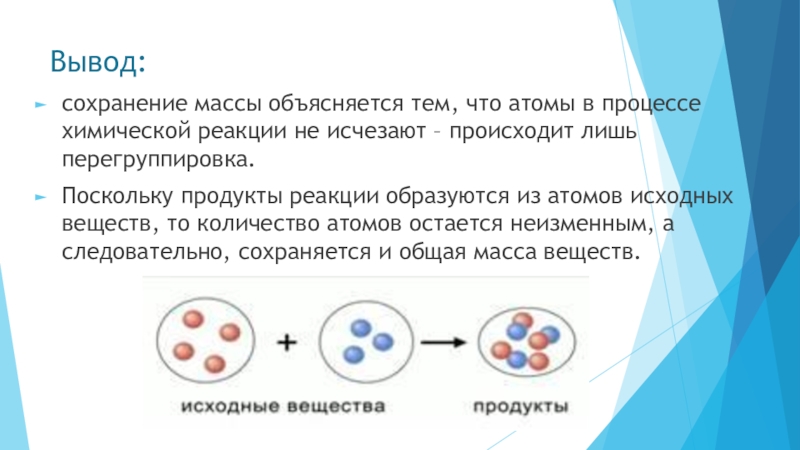
Слайд 10Вывод:
сохранение массы объясняется тем, что атомы в процессе химической реакции не
Поскольку продукты реакции образуются из атомов исходных веществ, то количество атомов остается неизменным, а следовательно, сохраняется и общая масса веществ.
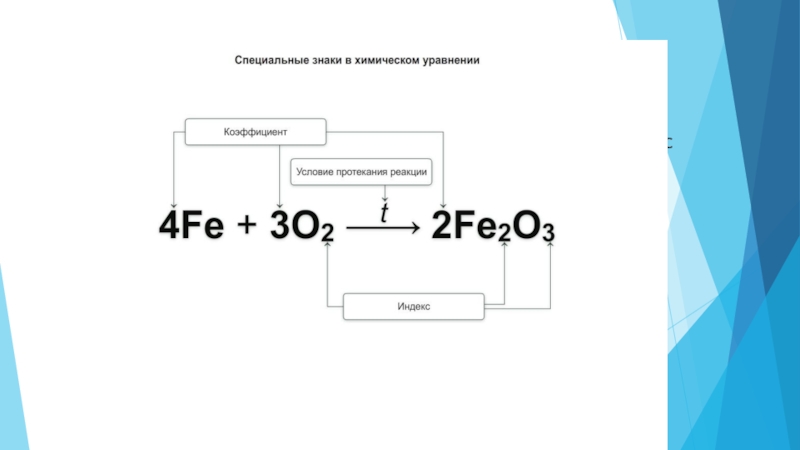
Слайд 11Как на письме отразить данный процесс – химическую реакцию?
Химическое уравнение –
Слайд 12Составление химических уравнений
1.
2. Начинаем с кислорода.
3. O — 2 атома слева O — 5 атомов справа
4. НОК — 10
5. 10 : 2 = 5 P + 5O2 → P2O5
6. 10 : 2 = 5 P + 5O2 → 2P2O5
7. В левую часть уравнения перед фосфором необходимо поставить коэффициент 4. 4P + 5O2 = 2P2O5
Слайд 13Закрепление
1. Расставить коэффициенты в химической реакции
2. Записать химическую реакцию химическими формулами и расставить коэффициенты
гидроксид железа (III) + азотная кислота → нитрат железа (III) + вода
Слайд 14Анкета
На уроке я работал
Своей работой на уроке я доволен/не доволен
Урок для меня показался коротким/длинным
За урок я не устал/устал
Материал урока мне был понятен/не понятен
полезен/бесполезен
интересен/скучен