- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Химические свойства металлов (9 класс)
Содержание
- 1. Презентация по химии на тему Химические свойства металлов (9 класс)
- 2. Металлы
- 3. Ряд активности металловУвеличение восстановительных свойств
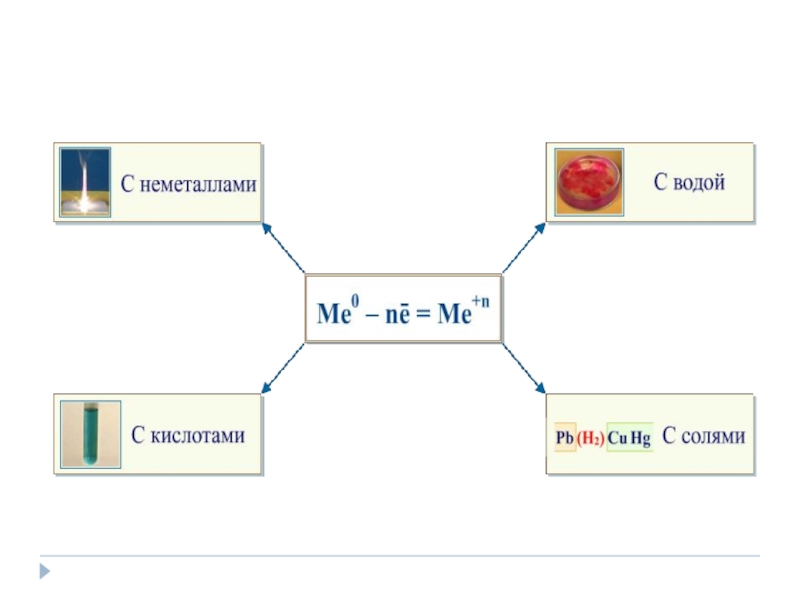
- 4. Химические свойства металловВзаимодействие с неметаллами:с кислородом
- 5. Взаимодействие со сложными веществами:с водой
- 6. Взаимодействие растворами кислот
- 7. Взаимодействие с растворами солейКаждый металл вытесняет из
- 8. Слайд 8
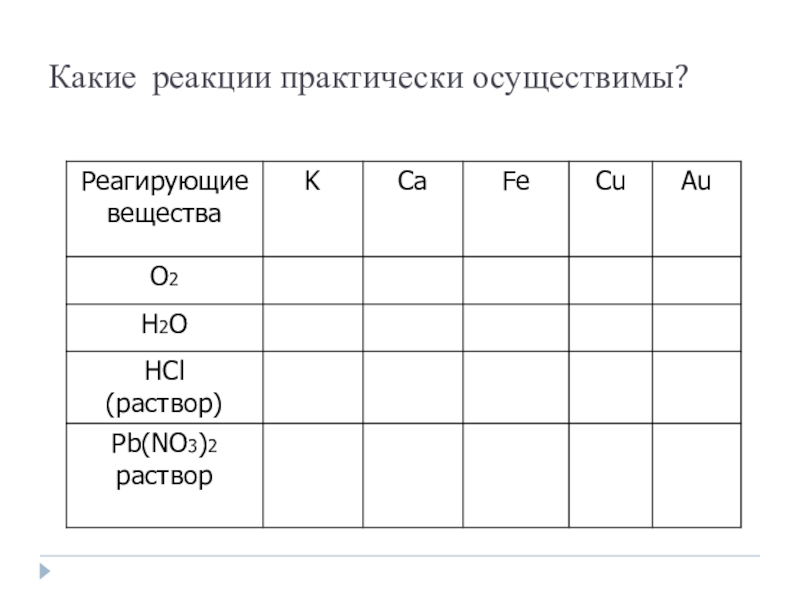
- 9. Какие реакции практически осуществимы?
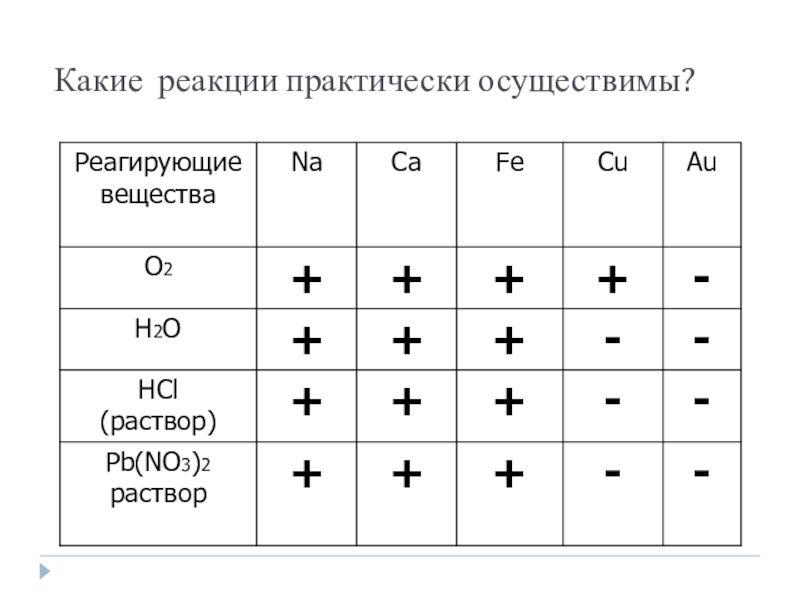
- 10. Какие реакции практически осуществимы?
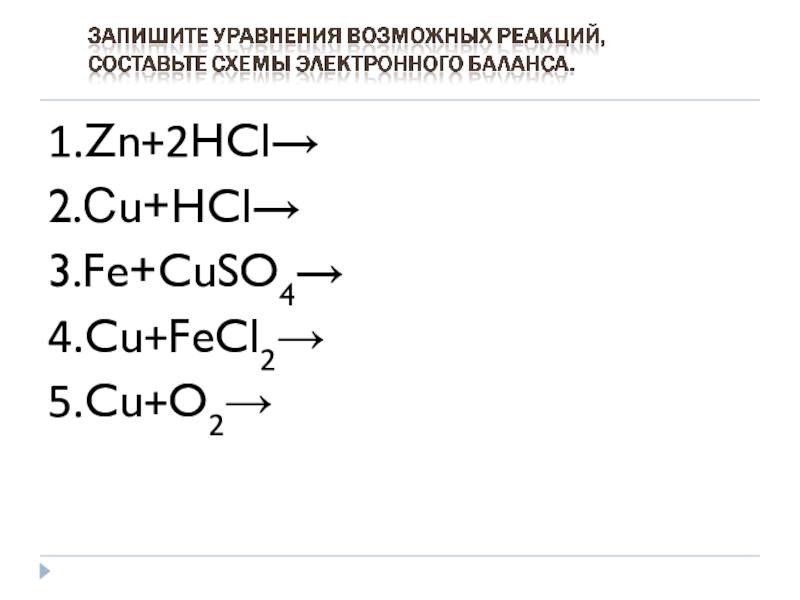
- 11. 1.Zn+2HCl→2.Сu+HCl→3.Fe+CuSO4→4.Cu+FeCl2→5.Cu+O2→
- 12. все ли реакции протекали? если не все,
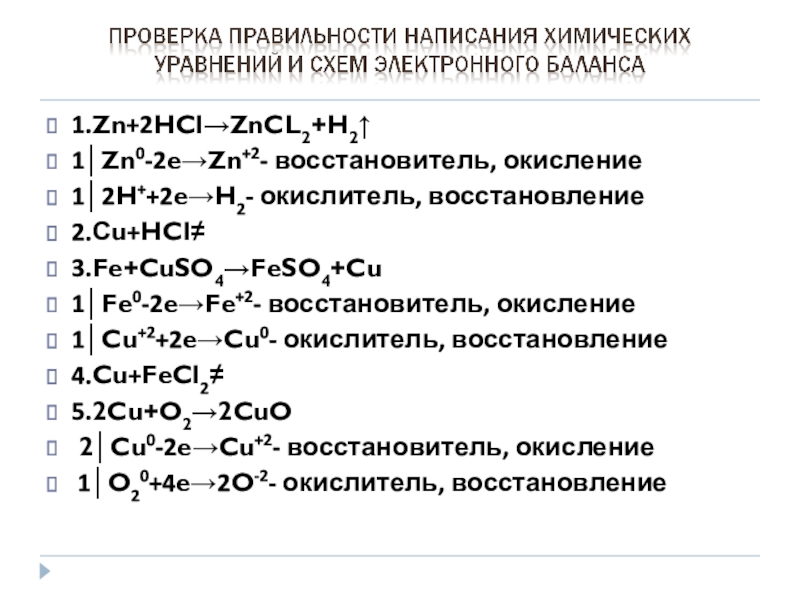
- 13. 1.Zn+2HCl→ZnCL2+H2↑1│Zn0-2e→Zn+2- восстановитель, окисление1│2H++2e→H2- окислитель, восстановление2.Сu+HCl≠ 3.Fe+CuSO4→FeSO4+Cu1│Fe0-2e→Fe+2- восстановитель,
Металлы
Слайд 7Взаимодействие с растворами солей
Каждый металл вытесняет из растворов солей другие металлы,
находящиеся правее него в ряду напряжений, и сам может быть вытеснен металлами, расположенными левее.
Слайд 12все ли реакции протекали?
если не все, то почему?
свойства окислителя
или восстановителя проявляют металлы в химических реакциях?
Слайд 131.Zn+2HCl→ZnCL2+H2↑
1│Zn0-2e→Zn+2- восстановитель, окисление
1│2H++2e→H2- окислитель, восстановление
2.Сu+HCl≠
3.Fe+CuSO4→FeSO4+Cu
1│Fe0-2e→Fe+2- восстановитель, окисление
1│Cu+2+2e→Cu0- окислитель, восстановление
4.Cu+FeCl2≠
5.2Cu+O2→2CuO
2│Cu0-2e→Cu+2- восстановитель, окисление
1│O20+4e→2O-2- окислитель, восстановление
1│O20+4e→2O-2- окислитель, восстановление