- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Химические свойства кислот
Содержание
- 1. Презентация по химии на тему: Химические свойства кислот
- 2. Кислотами называют
- 3. Классификация кислот
- 4. Слайд 4
- 5. Основность кислот зависит от количества
- 6. Знаете ли вы, что …
- 7. Получение кислот 1. Взаимодействие кислотных
- 8. Химические свойства
- 9. 2. Взаимодействуют с металлами. Разбавленная
- 10. 3. Взаимодействуют с основными
- 11. 5. Взаимодействуют с растворимыми и не
- 12. 6. Взаимодействуют с растворимыми и нерастворимыми
- 13. Применение кислот Серная кислота – бесцветная
- 14. При смешивании серной кислоты с водой
- 15. Чтобы этого не случилось, при растворении
- 16. Угольная и сернистая кислоты –
- 17. Задание: 1. Какие из веществ, формулы
- 18. 2. Какая из кислот богаче фосфором –фосфорная
- 19. 4. Напишите уравнения реакций, которые осуществимы:
- 20. Al + H2SO4 ->
- 21. Fe2O3 + H2SO4 -> Li2O +
Кислотами называют сложные вещества, молекулы которых состоят из атомов водорода , который может замещаться на атомы металлов, и кислотных остатков.
Слайд 2
Кислотами называют сложные вещества, молекулы
которых состоят из атомов водорода , который может замещаться на атомы металлов, и кислотных остатков.
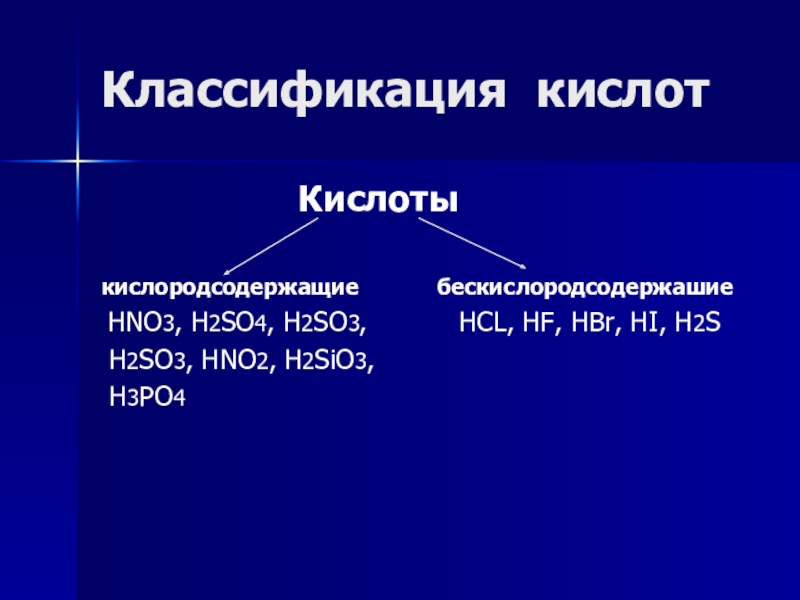
Слайд 3Классификация кислот
Кислоты
кислородсодержащие бескислородсодержашие
HNO3, H2SO4, H2SO3, HCL, HF, HBr, HI, H2S
H2SO3, HNO2, H2SiO3,
H3PO4
кислородсодержащие бескислородсодержашие
HNO3, H2SO4, H2SO3, HCL, HF, HBr, HI, H2S
H2SO3, HNO2, H2SiO3,
H3PO4
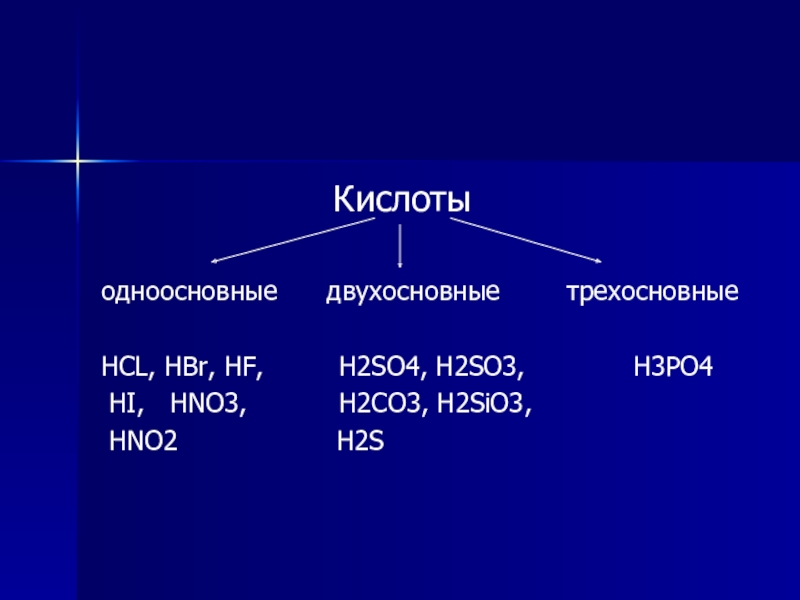
Слайд 4
Кислоты
одноосновные двухосновные трехосновные
HCL, HBr, HF, H2SO4, H2SO3, H3PO4
HI, HNO3, H2CO3, H2SiO3,
HNO2 H2S
одноосновные двухосновные трехосновные
HCL, HBr, HF, H2SO4, H2SO3, H3PO4
HI, HNO3, H2CO3, H2SiO3,
HNO2 H2S
Слайд 5
Основность кислот зависит от количества атомов водорода.
Валентность
кислотного остатка зависит от количества атомов водорода.
I II III
HCL, H2SO4, H3PO4
I II III
HCL, H2SO4, H3PO4
Слайд 6 Знаете ли вы, что
… кислоты разрушают живые
ткани и вызывают ожоги. Поэтому будьте осторожны в работе с кислотами!
… если кто-то выпил кислоту, то ему дают очень много воды. Для нейтрализации кислоты применять раствор питьевой соды не рекомендуется, так как в органах пищеварения образуется пена, которая может вызвать осложнения.
… если кто-то выпил кислоту, то ему дают очень много воды. Для нейтрализации кислоты применять раствор питьевой соды не рекомендуется, так как в органах пищеварения образуется пена, которая может вызвать осложнения.
Слайд 7 Получение кислот
1. Взаимодействие кислотных оксидов с водой.
H2O + SO3 => H2SO4
2. Синтез простых веществ.
H2 + CL2 => 2HCL
3. Взаимодействие кислот с солями.
2NaCL + H2SO4 => Na2SO4 + 2HCL
2. Синтез простых веществ.
H2 + CL2 => 2HCL
3. Взаимодействие кислот с солями.
2NaCL + H2SO4 => Na2SO4 + 2HCL
Слайд 8Химические свойства
кислот
1. Растворимые в воде кислоты изменяют окраску индикаторов.
Нерастворимые кислоты не изменяют цвета индикаторов и не взаимодействуют с металлами.
Лакмус – красный цвет;
Метиловый оранжевый – красно- розовый;
Фенолфталеин - бесцветная.
Слайд 9
2. Взаимодействуют с металлами. Разбавленная H2SO4 и HCL
взаимодействуют с металлами, стоящими в электрохимическом ряду напряжения металлов до водорода.
Na + H2SO4 => Na2SO4 + H2
Au + H2SO4 ->
Na + H2SO4 => Na2SO4 + H2
Au + H2SO4 ->
Слайд 10
3. Взаимодействуют с основными
оксидами:
2HCL + CaO => CaCL2 + H2O
4. Взаимодействуют с амфотерными оксидами:
2HCL + ZnO => ZnCL2 + H2O
2HCL + CaO => CaCL2 + H2O
4. Взаимодействуют с амфотерными оксидами:
2HCL + ZnO => ZnCL2 + H2O
Слайд 11
5. Взаимодействуют с растворимыми и не растворимыми основаниями:
H2SO4 +
2NaOH =>Na2SO4 + 2H2O
Fe(OH)3 + 3HNO3 =>Fe(NO3)3 + 3H2O
Fe(OH)3 + 3HNO3 =>Fe(NO3)3 + 3H2O
Слайд 12
6. Взаимодействуют с растворимыми и нерастворимыми солями. Реакция идет в
том случае, если образуется газ или осадок.
CaCO3 +2HCL = CaCL2 + H2CO3
CO2 H2O
BaCL2 + H2SO4 = BaSO4 + 2HCL
CaCO3 +2HCL = CaCL2 + H2CO3
CO2 H2O
BaCL2 + H2SO4 = BaSO4 + 2HCL
Слайд 13 Применение кислот
Серная кислота – бесцветная жидкость, вязкая, как масло,
не имеющая запаха, почти вдвое тяжелее воды. Она поглощает влагу из воздуха и других газов. Это свойство серной кислоты используют для осушения некоторых газов.
Слайд 14
При смешивании серной кислоты с водой выделяется большое
количество теплоты. Если воду вливать в серную кислоту, то вода, не успев смешаться с кислотой, может закипеть и выбросить брызги серной кислоты на лицо и руки работающего.
Слайд 15
Чтобы этого не случилось, при растворении серной кислоты нужно вливать
ее тонкой струей в воду и перемешивать.
Серная кислота обугливает кожу,
древесину, ткани.
Серная кислота обугливает кожу,
древесину, ткани.
Слайд 16
Угольная и сернистая кислоты – в свободном виде не
существуют, так как они разлагаются на воду и соответствующий оксид (газ):
H2CO3 CO2 + H2O,
H2SO3 SO2 + H2O
H2CO3 CO2 + H2O,
H2SO3 SO2 + H2O
Слайд 17 Задание:
1. Какие из веществ, формулы которых приведены, реагируют с
соляной кислотой:
a) CuO; б) Cu;
в) Cu(OH)2; г) Ag; д) AL (OH)3?
Напишите уравнения практически осуществимых реакций.
a) CuO; б) Cu;
в) Cu(OH)2; г) Ag; д) AL (OH)3?
Напишите уравнения практически осуществимых реакций.
Слайд 18
2. Какая из кислот богаче фосфором –фосфорная H3PO4 или метафосфорная
HPO3 ?
3. В реакции алюминия с серной кислотой образовалось 3,42 г сульфата алюминия. Определите массу и количество алюминия, вступившего в реакцию.
3. В реакции алюминия с серной кислотой образовалось 3,42 г сульфата алюминия. Определите массу и количество алюминия, вступившего в реакцию.
Слайд 19
4. Напишите уравнения реакций, которые осуществимы:
Na + HCl ->
Mg + HCl ->
Al + HCL ->
Mg + H3PO4 ->
Ca + H2SO4 ->
Al + HCL ->
Mg + H3PO4 ->
Ca + H2SO4 ->
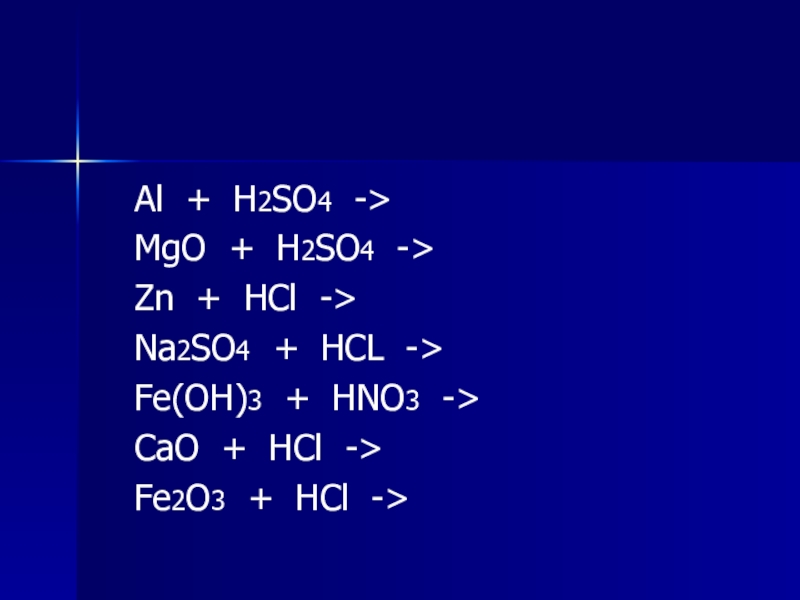
Слайд 20
Al + H2SO4 ->
MgO + H2SO4
->
Zn + HCl ->
Na2SO4 + HCL ->
Fe(OH)3 + HNO3 ->
CaO + HCl ->
Fe2O3 + HCl ->
Zn + HCl ->
Na2SO4 + HCL ->
Fe(OH)3 + HNO3 ->
CaO + HCl ->
Fe2O3 + HCl ->