- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Химическая кинетика
Содержание
- 1. Презентация по химии на тему Химическая кинетика
- 2. Тема: Химическая кинетика и катализПлан1. Предмет химической
- 3. Понятие о скорости химической реакциис1-начальная концентрацияс2-концентрация в
- 4. Термин «скорость» в физике и химии
- 5. УПРАЖНЕНИЯ
- 6. Природа реагирующих веществ.Реакционная активность веществ определяется характером
- 7. Концентрация.скорость химической реакции при данной температуре прямо
- 8. Если реакция протекает в гетерогенной системе, например
- 9. ЗадачаВычислите, во сколько раз увеличится скорость реакции
- 10. Вант-Гофф Якоб-Хендрик (1852—1911)Голландский ученый.Разработал теорию пространственного расположения
- 11. Гульдберг Като Максимилиан (1836—1902)Норвежский физикохимик. Основные
- 12. Ловиц Товий (Иоганн Тобиас) Егорович (1757—1804)Немецкий ученый.
- 13. ТемператураСкорость химической реакции возрастает с повышением температуры.
- 14. Энергия активацииЗначительное увеличение скорости реакции с изменением
- 15. Задача
- 16. КАТАЛИЗАТОРЫ — это вещества, которые изменяют скорость
- 17. Действие катализаторов специфично: ускоряя протекание одной реакции,
- 18. В зависимости от агрегатного состояния реагирующих веществ
- 19. Гомогенный катализ— катализатор и реагирующие вещества находятся
- 20. Упражнения 1. На основании закона действия масс
Слайд 2Тема: Химическая кинетика и катализ
План
1. Предмет химической кинетики. Понятие о скорости
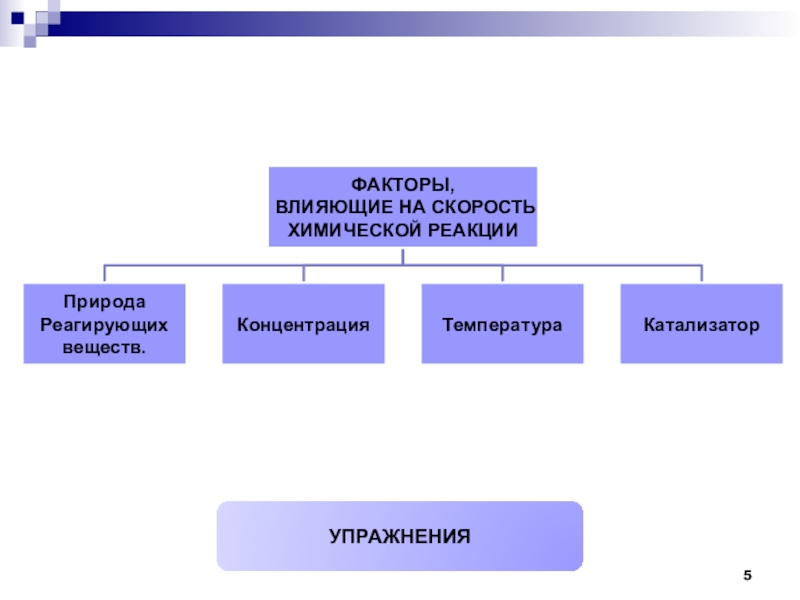
2. Факторы, влияющие на скорость химической реакции:
природа реагирующих веществ,
концентрация
температура
катализаторы
3. Катализ
4. Упражнения
Домашнее задание: В.Е. Липатников, К.М. Казаков. Физическая и коллоидная химия – М., Высшая школа, 2000, гл. IV §10, 11, задача 25 стр. 222
Слайд 3Понятие о скорости химической реакции
с1-начальная концентрация
с2-концентрация в момент времени t2
t1- начальное
t2- время окончания эксперимента
Изменение концентрации реагирующих веществ во времени
Слайд 6Природа реагирующих веществ.
Реакционная активность веществ определяется характером химических связей в соединениях
Например, выделение водорода цинком из раствора хлороводорода происходит значительно быстрее, чем из раствора уксусной кислоты. Связь Н—С1 в молекуле хлороводорода более полярна, чем связь О—Н в молекуле СН3СООН, поэтому концентрация ионов водорода в растворе НСl больше (сильный электролит) по сравнению с раствором уксусной кислоты (слабый электролит).
Слайд 7Концентрация.
скорость химической реакции при данной температуре прямо пропорциональна произведению молярных концентраций
Этот закон сформулирован норвежскими учеными К. Гульдбергом и П. Вааге в 1867 г.
Например, для элементарной гомогенной реакции, записанной в общем виде;
аА + bВ = сС + dD
математически закон выражается соотношением:
v = k[A]a•[B]ь,
где v — скорость реакции; [А] и [В] — молярные концентрации реагирующих веществ; а и b — стехиометрические коэффициенты; k — константа скорости реакции. Она зависит от природы реагирующих веществ, температуры, катализатора, но не зависит от концентрации реагирующих веществ.
Значение k численно равно скорости реакции (v = k) при концентрации реагирующих веществ, равной 1 моль/л
Реакция происходит при столкновении молекул реагирующих веществ, ее скорость определяется количеством столкновений и их силой (энергией).
. Количественно зависимость скорости реакции от концентрации реагирующих веществ выражают законом действующих масс:
Слайд 8Если реакция протекает в гетерогенной системе, например газ — твердое вещество,
Например, для гетерогенной реакции горения серы:
S(тв)+О2=SO2
закон действующих масс имеет следующее выражение:
v= k[О2],
т. е. скорость реакции пропорциональна только концентрации кислорода.
Для гетерогенных реакций скорость прямо пропорциональна поверхности соприкосновения реагирующих веществ.
Твердое вещество необходимо измельчить, если возможно растворить в воде (измельчить до молекул)
Слайд 9Задача
Вычислите, во сколько раз увеличится скорость реакции
2NO + О2 =
если повысить концентрацию NО в два раза.
Решение
1. Согласно закону действия масс:
v = k [NO]2 • [О2]. (1)
2. Обозначим концентрацию NО через а, концентрацию О2 — через b, тогда уравнение (1) примет вид (скорость реакции до изменения концентрации):
v = k а2b
3. Определяем скорость реакции при увеличении концентрации NO в два раза:
[NO]=2а, [О2]= b, тогда v2= k(2а)2b = k 4а2b
4. Находим отношение скоростей:
Ответ: скорость реакции увеличивается в четыре раза.
Слайд 10Вант-Гофф Якоб-Хендрик
(1852—1911)
Голландский ученый.
Разработал теорию пространственного расположения атомов в молекулах, вывел ряд
Первый лауреат Нобелевской премии по химии
Слайд 11Гульдберг Като Максимилиан
(1836—1902)
Норвежский физикохимик.
Основные труды по химической кинетике и
Нашел уравнения для вычисления коэффициента расширения тел, теплот плавления и теплоемкостей
Слайд 12Ловиц Товий (Иоганн Тобиас) Егорович
(1757—1804)
Немецкий ученый. Химик и фармацевт. С 1768
Открыл (1785) и изучил адсорбцию растворенных веществ древесным углем, образование пересыщенных растворов.
Изучил теорию катализа.
Впервые получил ледяную уксусную кислоту (1789) и многие другие соединения.
Слайд 13Температура
Скорость химической реакции возрастает с повышением температуры. При комнатной температуре образование
Зависимость скорости реакции от температуры выражается правилом Вант-Гоффа:
ПОВЫШЕНИЕ ТЕМПЕРАТУРЫ НА КАЖДЫЕ 10 ГРАДУСОВ УВЕЛИЧИВАЕТ СКОРОСТЬ БОЛЬШИНСТВА РЕАКЦИЙ В 2—4 РАЗА.
Слайд 14Энергия активации
Значительное увеличение скорости реакции с изменением
температуры объясняет теория активации
Согласно
Один из способов повышения активности молекул – повышение температуры. Энергия, которую надо сообщить молекулам реагирующих веществ, чтобы превратить их в активные, называется ЭНЕРГИЕЙ АКТИВАЦИИ Еа.
Значение энергии активации зависит от природы реагирующих веществ. При одинаковых условиях наибольшую скорость имеют те реакции, для которых энергия активации меньше. Если энергия активации при комнатной температуре меньше 40 кДж/моль, то большая часть соударений частиц реагирующих веществ приводит к взаимодействию. Реакции ионного обмена протекают практически мгновенно, так как взаимодействие происходит между разноименно заряженными ионами
Чем выше энергия активации, тем меньше доля активных молекул. Если энергия активации реакции больше 120 кДж/моль, то в такой реакции лишь ничтожная доля столкновений между взаимодействующими частицами приводит к взаимодействию. Скорость таких реакций очень мала. Реакцией с высокой энергией активации является синтез аммиака из азота и водорода. Протекание этой реакции при комнатной температуре практически невозможно.
Реакции с промежуточными значениями энергии активации (40—120 кДж/моль) протекают со средней скоростью (взаимодействие цинка с раствором серной кислоты, обесцвечивание бромной воды этиленом и др.).
Слайд 16КАТАЛИЗАТОРЫ — это вещества, которые изменяют скорость реакции, но сами не
Химические реакции, которые протекают в присутствии катализаторов, называют КАТАЛИТИЧЕСКИМИ.
Изучением каталитических реакций занимался немецкий ученый Ловиц Товий.
Действие катализатора объясняется тем, что он снижает энергию активации, необходимую для протекания реакции. При окислении SO2 до SO3 на катализаторе V2O5 последний снижает энергию активации с 240 до 60 кДж/моль.
Снижение энергии активации, необходимой для протекания реакции, является главной причиной ускоряющего действия катализаторов. С участием катализатора реакции протекают при температуре более низкой, чем без него.
Катализаторы
Слайд 17Действие катализаторов специфично: ускоряя протекание одной реакции, катализатор может оказаться неэффективным
Особенно высокой специфичностью отличаются ферменты
Биологические катализаторы, являющиеся продуктами деятельности живых организмов и ускоряющие биохимические процессы, называются ферментами.
Реакцию в присутствии ферментов можно сравнить с замком, а фермент с ключом, который подходит только к этому замку. Например, для гидролиза различных углеводов необходимы различные ферменты: для крахмала – амилаза, для сахарозы – сахараза, для мальтозы – мальтаза.
Ферменты имеют огромное значение, так как природные биохимические процессы в основном имеют ферментативный характер. Ферментативные процессы используются при изготовлении спирта, пива, кваса, хлеба, квашенной капусты и т. д.
В хлебопечении особенное значение играют амилазы. Расщепляющие крахмал, и протеазы, расщепляющие белок. От активности амилаз зависит скорость брожения теста. В спиртовой и пивоваренной промышленности используются амилазы, источником которых могут быть солод и микробные препараты. В виноделии и при ферментации табака применяется фермент полифенолоксидаза, от активности которой зависит букет и цвет вина и сортовые качества табака.
ферменты
Слайд 18В зависимости от агрегатного состояния реагирующих веществ и катализаторов различают гомогенный
— катализатор и реагирующее вещество находятся в разных фазах (обычно катализатор — твердое вещество, реагирующие вещества — газы или жидкости).
Например реакции гидрирования, окисления аммиака в присутствии платины.
Все реакции при гетерогенном катализе протекают на поверхности катализатора. Поэтому активность твердого катализатора зависит от размера, химического состава, строения и состояния его поверхности.
Поверхность катализатора неоднородна. Полагают, что на ней существуют активные центры, на которых главным образом и протекают каталитические реакции. При этом реагирующее вещество, например водород, адсорбируется на этих центрах, в результате чего у адсорбированных молекул ослабевают связи между атомами и увеличиваются расстояния они становятся более реакционноспособными. Для того чтобы реакция началась, потребуется меньшая энергия активации, чем для той же реакции, но без катализатора
Гетерогенный катализ
Слайд 19Гомогенный катализ
— катализатор и реагирующие вещества находятся в одной фазе (газовая
Например окисление SO2 до SO3 в присутствии N0 или образование простых и сложных эфиров в присутствии минеральных кислот.
Механизм действия гомогенного катализа объясняется теорией промежуточных соединений, согласно которой в присутствии катализатора реакция протекает в несколько стадий.
Реакция (А + В = АВ) без катализатора протекает медленно вследствие большой энергии активации этой реакции.
Катализатор К вступает во взаимодействие с одним из исходных веществ А, образуя промежуточное соединение АК (А + К = АК). Эта реакция протекает быстро, так как ее энергия активации имеет небольшое значение.
Образовавшееся промежуточное соединение АК по той же причине легко реагирует со вторым исходным веществом В,
Образуется конечный продукт АВ и катализатор К, который может участвовать в новой реакции.
Схематически действие катализатора NО можно представить на примере окисления SO2 до SO3
SO2 + 1/2O2= SO3 (без катализатора реакция идет медленно)
NO + 1/2O2= NO2 (NO2— промежуточное соединение)
NO2 + SO2 = SO3 + NO (катализатор NO после реакции оказывается в неизменном виде)
Ускорение реакции происходит благодаря тому, что скорость отдельных стадий во много раз больше скорости реакции: SO2 + 1/2O2= SO3
Слайд 20Упражнения
1. На основании закона действия масс запишите формулы скорости для
а) СН4 + СО2 = 2СО + 2Н2; в) 2NO2 = N2О4;
б) С(тв) + СО2 (г) = 2СО(г); г) СuО (тв) + H2 (г) = Сu (тв) + H2O (г).
2. В системе Н2+J2 2HJ установилось равновесие.
Как изменится скорость прямой реакции, если концентрацию Н2 увеличить в 3 раза?
3. Вычислите, как изменится скорость химической реакции
2NO + О2 = 2NO2
а) при уменьшении концентрации исходных веществ в три раза;
б) при увеличении давления в три раза.
4. Вычислите, как изменится скорость прямой реакции, если концентрацию аммиака увеличить в 3 раза.