молекулу – вопрос…
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Химическая связь(8 класс)
Содержание
- 1. Презентация по химии на тему Химическая связь(8 класс)
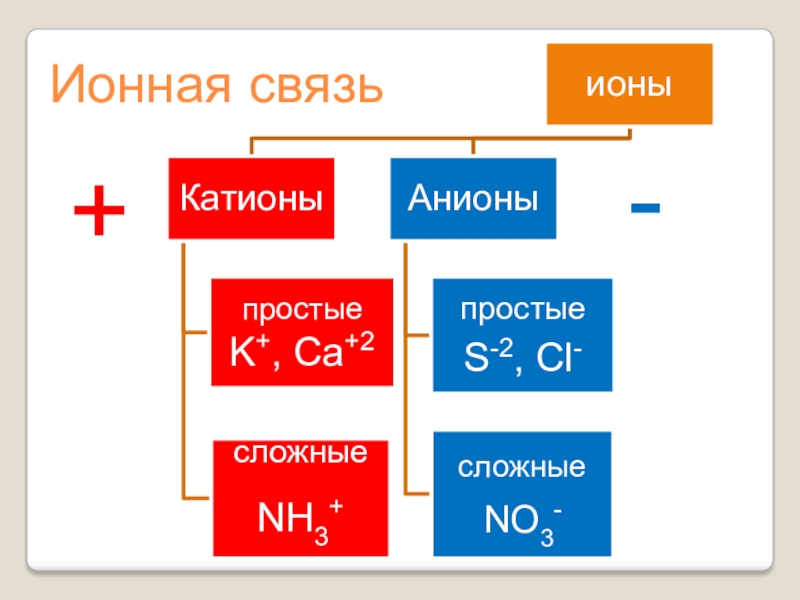
- 2. Ионная связь+-
- 3. Образование катионов 11+(-11)=0
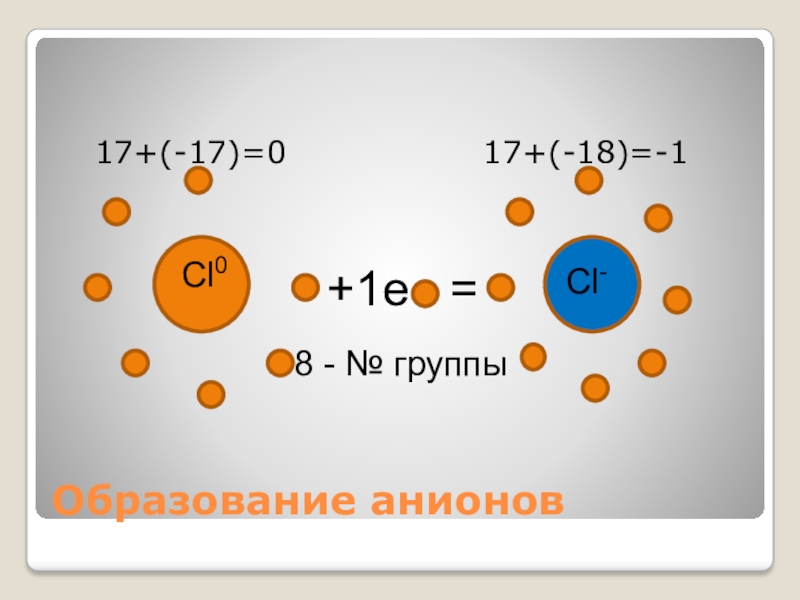
- 4. Образование анионов 17+(-17)=0
- 5. Электроотрицательность (ЭО)Способность присоединять электроныЭО(ме)
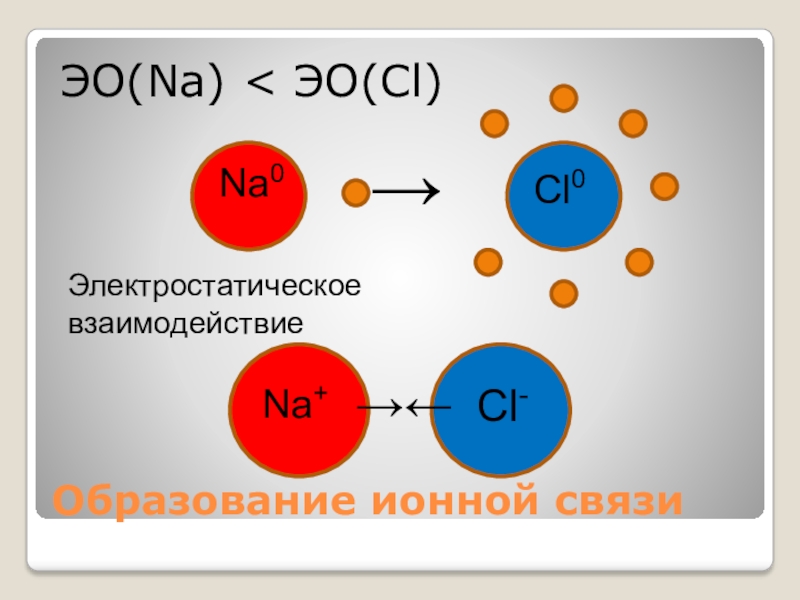
- 6. Образование ионной связиЭО(Na) < ЭО(Cl)Na0Cl0→Na+Cl-Электростатическое взаимодействие→←
- 7. Связь между заряженными частицами (ионами) за счёт электростатического взаимодействия+-
- 8. Алгоритм записи образования ионной связиЭО(Са)
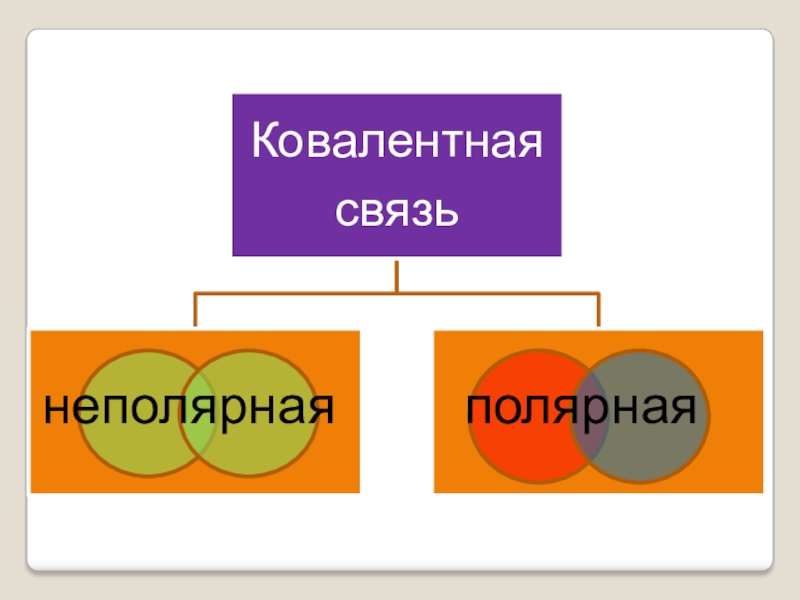
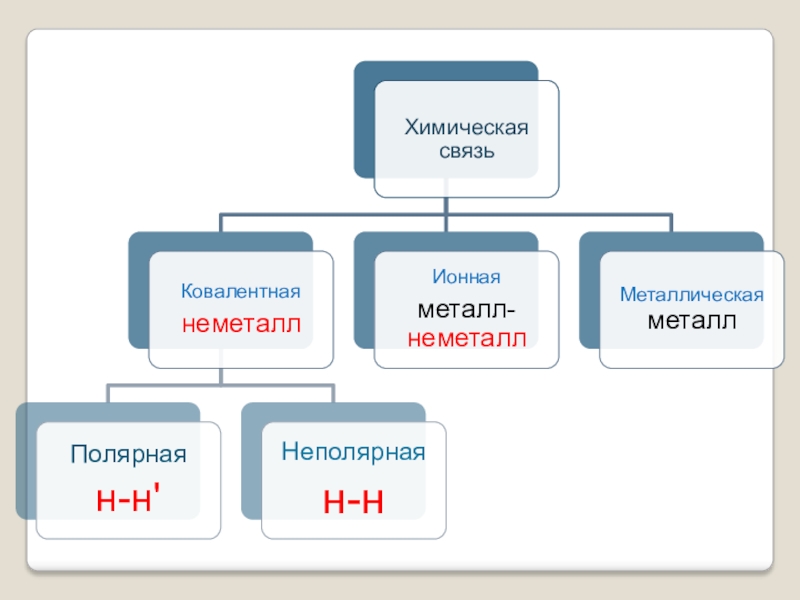
- 9. неполярнаяполярная
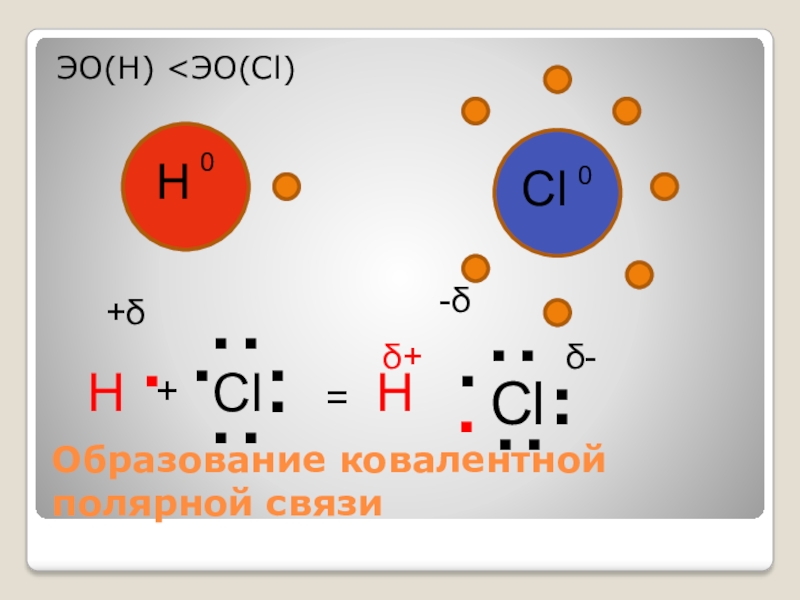
- 10. .Образование ковалентной полярной связи..ClЭО(Н)
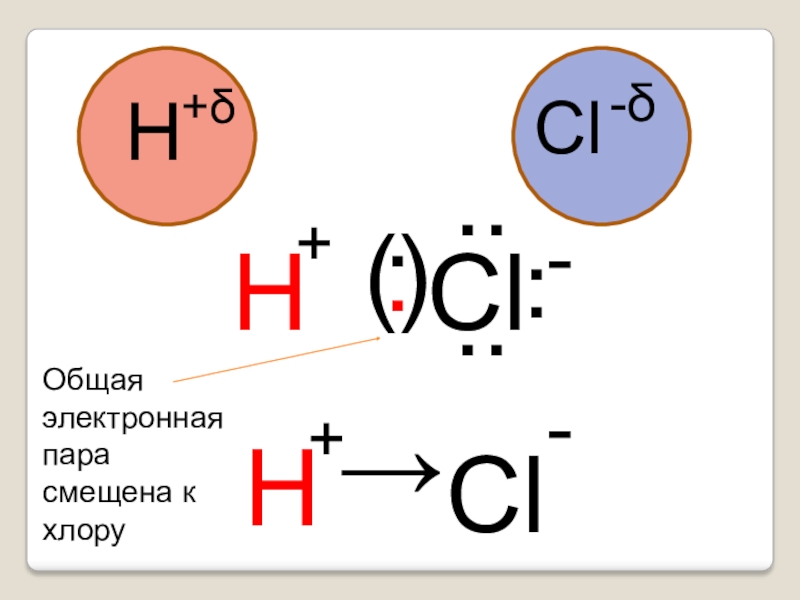
- 11. .(.)..ClH+δCl-δH....H→Cl+-+-Общая электронная парасмещена к хлору
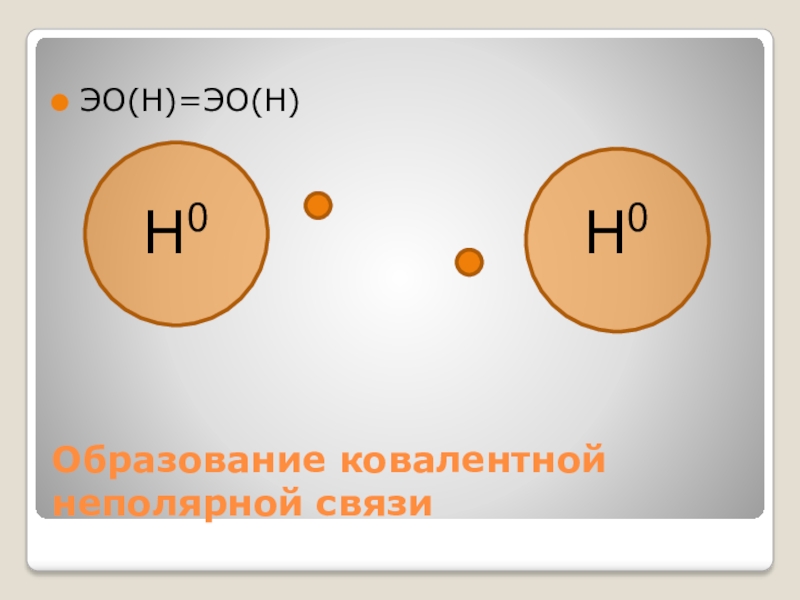
- 12. Образование ковалентной неполярной связиЭО(Н)=ЭО(Н)Н0Н0
- 13. Образование металлической связи++++Атом-ионэлектроны
- 14. Запись образования металлической связиК0 – 1е =
- 15. Слайд 15
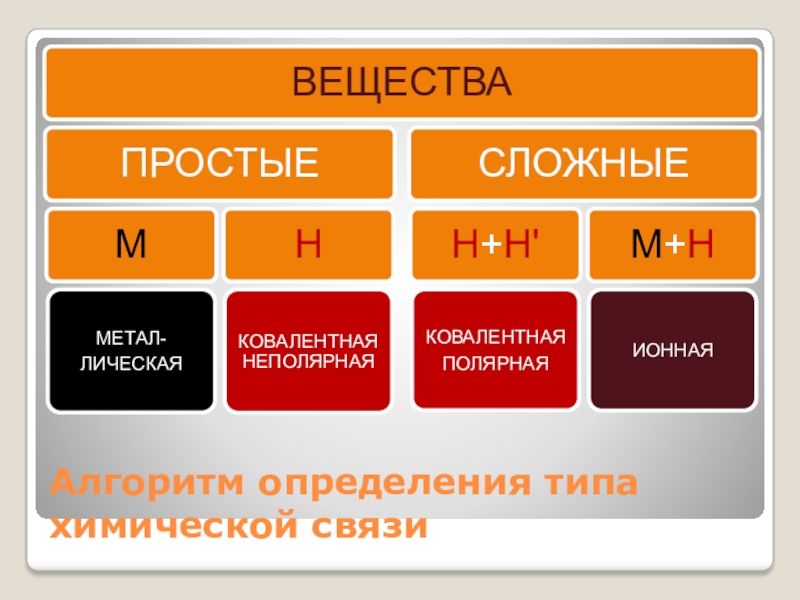
- 16. Алгоритм определения типа химической связи
Ионная связь+-
Слайд 5Электроотрицательность (ЭО)
Способность присоединять электроны
ЭО(ме)
убывает
-в периодах справа налево -убывает
-в периодах справа налево -убывает
Слайд 8
Алгоритм записи образования ионной связи
ЭО(Са) < ЭО(Сl)
Сa0
– 2е = Сa+2 Cl 0 + 1e = Cl –
Наименьшее общее кратное (нок) отданных и принятых электронов равно 2.
С одним катионом кальция (2:2=1) - Ca +2 соединяются 2 аниона хлора (2:1=2) - 2Сl –
Сa0 + Cl 0 = Сa2+ + 2Cl – = Сa2+Cl2– - формула
Наименьшее общее кратное (нок) отданных и принятых электронов равно 2.
С одним катионом кальция (2:2=1) - Ca +2 соединяются 2 аниона хлора (2:1=2) - 2Сl –
Сa0 + Cl 0 = Сa2+ + 2Cl – = Сa2+Cl2– - формула
Слайд 14Запись образования металлической связи
К0 – 1е = К+
Мg0 – 2e =
Mg2+
Al0 – 3e = Al3+
Al0 – 3e = Al3+
Количество электронов на последнем уровне
(номер группы)