Выполнила: учитель химии ГБОУ
СОШ №262
Абакумова Татьяна Савельевна
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Гидролиз солей
Содержание
- 1. Презентация по химии на тему Гидролиз солей
- 2. Это слово включает две составные части от
- 3. План.1. Гидролиз солей:а) образованных сильным основанием и
- 4. Задача. При сливании раствора, содержащего 5моль хлорида меди
- 5. Слайд 5
- 6. Лабораторная работа: «Изменения цвета универсальной индикаторной бумаги
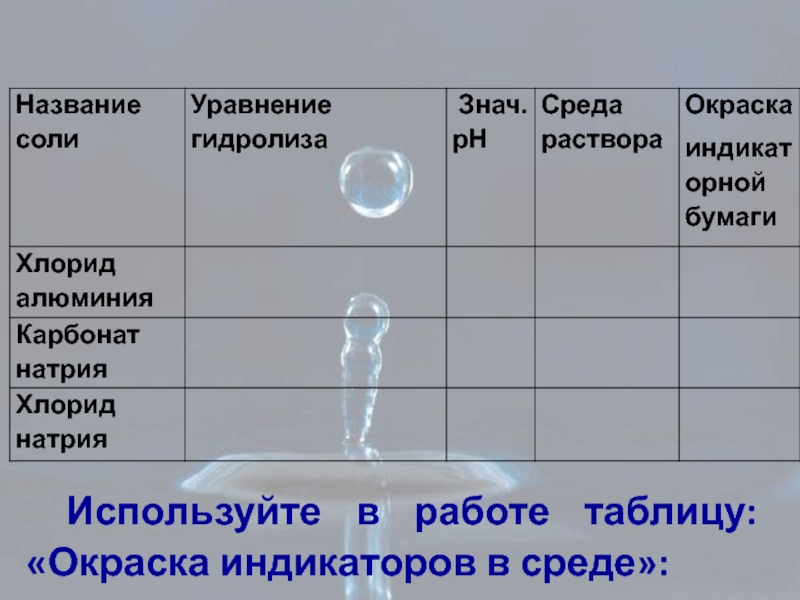
- 7. Используйте в работе таблицу: «Окраска индикаторов в среде»:
- 8. Хлорид алюминия образован слабым основанием и сильной
- 9. 3.Запишем ионное сокращенное уравнение гидролиза.Al3++HOHAlOH2++H+4.Запишем ионное полное уравнение : Al3++HOH3Cl+AlOH2++H+3CI_+_
- 10. AlCl3 + H2O
- 11. Вывод.
- 12. 1.Карбонат натрия-соль образована сильным основанием и cлабой
- 13. 3.Составляем ионное сокращённоеуравнение.CO 32-+H+OH-HCO3-+OH- 4. Составляем ионное полное уравнение.2Na+CO3+HOHHCO3 + OH+2Na+2-__+
- 14. Составляем молекулярное уравнение, зная исходные вещества гидролиза,
- 15. Вывод.
- 16. Хлорид натрия – соль, образована сильным основанием
- 17. Na+ + Cl – + HOH ↔ Na+ + OH – + H+ +
- 18. Вывод.Раствор соли, образованной сильным основанием и сильной
- 19. Соли, образованные слабым основанием и слабой летучей
- 20. Продукты гидролиза зависят от соотношения констант диссоциации
- 21. Гидролиз – это обменная реакция соли с водой, в результате которой образуются малодиссоциирующие электролиты.
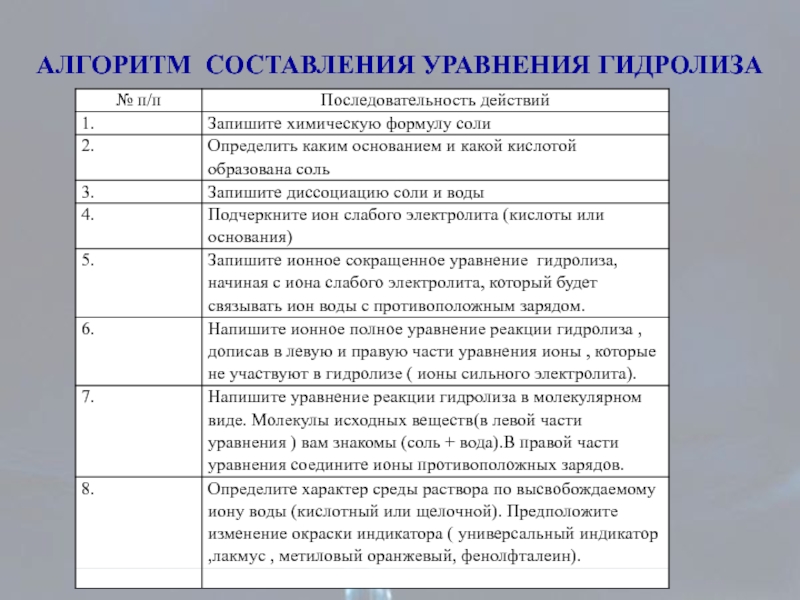
- 22. АЛГОРИТМ СОСТАВЛЕНИЯ УРАВНЕНИЯ ГИДРОЛИЗА
- 23. Ответы вопросов теста. 1.-(а) ,2- (б
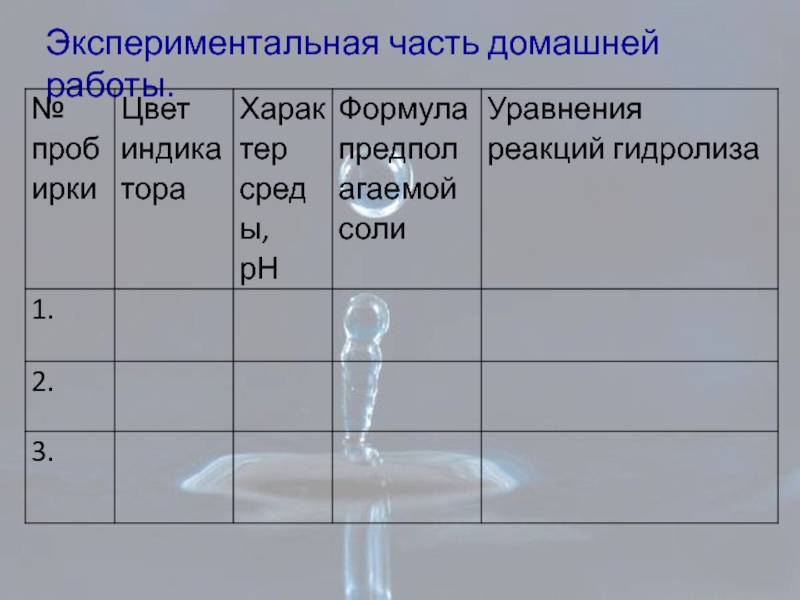
- 24. Экспериментальная часть домашней работы.
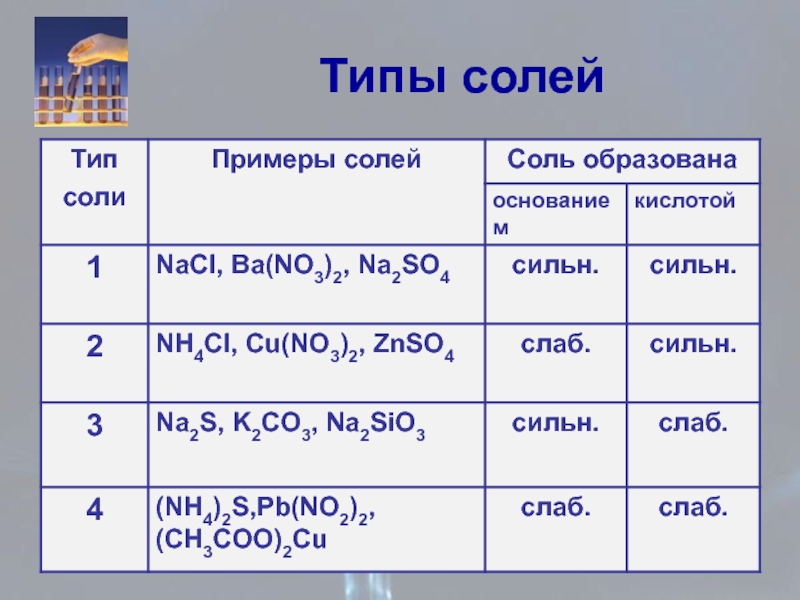
- 25. Типы солей
- 26. Спасибо за урок.
Слайд 1
немецкий химик Юстус Либих
Гидролиз солей
«Нет искусства столь же трудного, как
Слайд 2Это слово включает две составные части от греческого «гидро» – вода,
Гидролиз.
Слайд 3План.
1. Гидролиз солей:
а) образованных сильным основанием и сильной кислотой;
б) образованных сильным
в) образованных слабым основанием и сильной кислотой;
г) образованных слабым основанием и слабой кислотой.
2. Факторы влияющие на процесс гидролиза.
3. Значение и применение гидролиза.
Слайд 4Задача.
При сливании раствора, содержащего 5моль хлорида меди (II), с избытком раствора
Слайд 6
Лабораторная работа: «Изменения цвета универсальной индикаторной бумаги в растворах солей ,определение
В трёх пробирках находятся вещества: раствор хлорида алюминия, карбонат натрия, хлорид натрия.
. Используя универсальную индикаторную бумагу, исследуйте растворы этих веществ.
Сделайте вывод о среде растворов и значении рН, укажите окраску индикаторной бумаги в растворах солей.
Заполните таблицу:
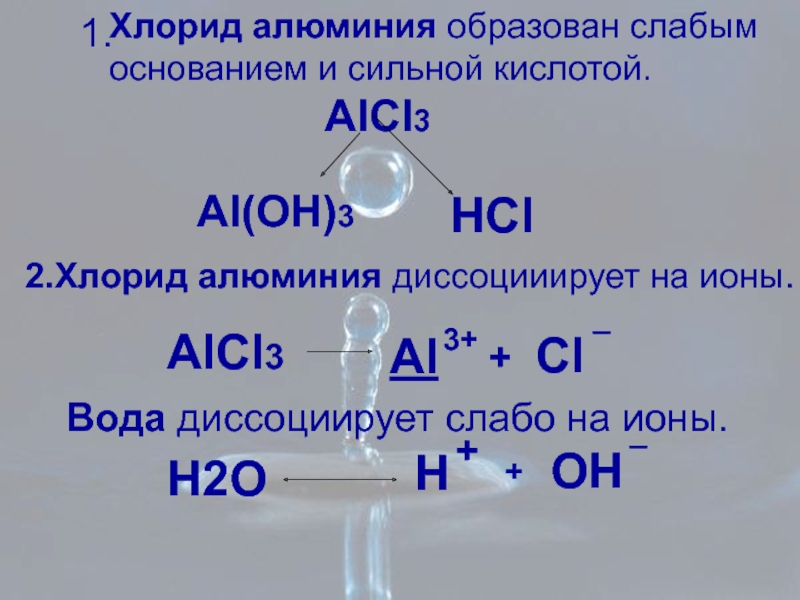
Слайд 8Хлорид алюминия образован слабым
основанием и сильной кислотой.
AlCl3
Al(OH)3
HCl
Вода диссоциирует слабо на
H2O
1.
H
+
+
OH
_
2.Хлорид алюминия диссоцииирует на ионы.
AlCl3
Al
3+
+
Cl
_
Слайд 93.Запишем ионное сокращенное уравнение гидролиза.
Al
3+
+
H
OH
AlOH
2+
+
H
+
4.Запишем ионное полное уравнение :
Al
3+
+
H
OH
3Cl
+
AlOH
2+
+
H
+
3CI
_
+
_
Слайд 10AlCl3 + H2O AlOHCl2 + HCl
5.Составим
Концентрация ионов водорода больше концентрации гидроксид-ионов.
[H]+ > [OH]- ,следовательно рН< 7
Слайд 11Вывод.
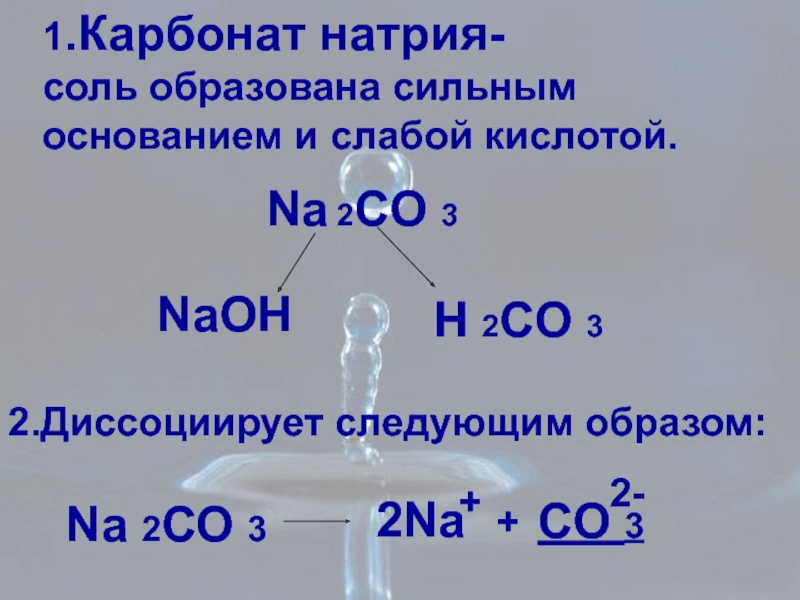
Слайд 121.Карбонат натрия-
соль образована сильным
основанием и cлабой кислотой.
Na 2CO 3
NaOH
H 2CО
2.Диссоциирует следующим образом:
Na 2СО 3
+
+
2Na
CO 3
2-
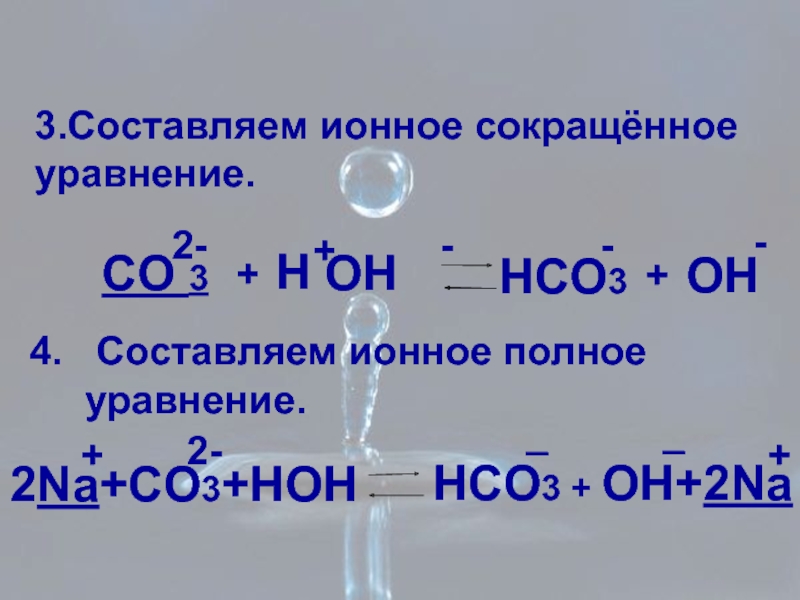
Слайд 133.Составляем ионное сокращённое
уравнение.
CO 3
2-
+
H
+
OH
-
HCO3
-
+
OH
-
4. Составляем ионное полное
2Na+CO3+HOH
HCO3 + OH+2Na
+
2-
_
_
+
Слайд 14Составляем молекулярное уравнение, зная исходные вещества гидролиза, продукты гидролиза составим, связывая
Na2CO3 + H2O NaHCO3 + NaOH
[OH]- > [H]+ ,следовательно рН > 7
Слайд 15Вывод.
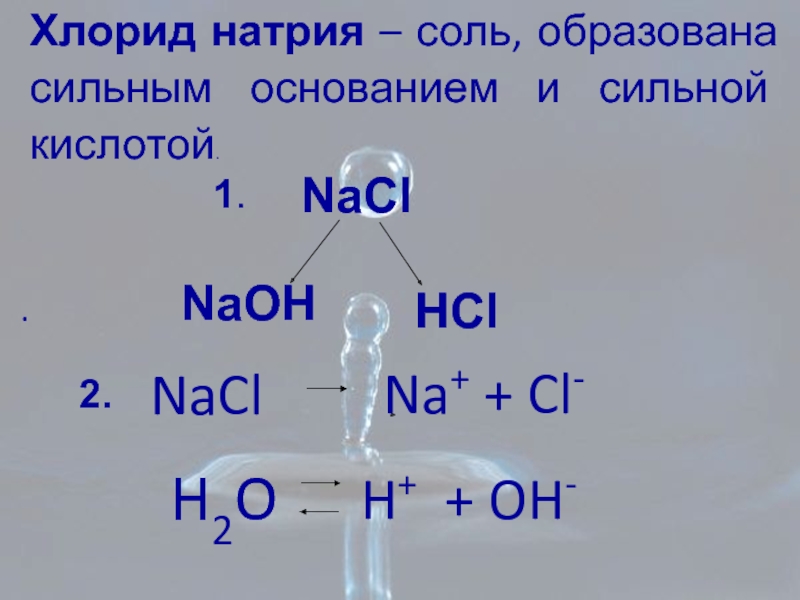
Слайд 16Хлорид натрия – соль, образована сильным основанием и сильной кислотой.
NaCl
H+ + OH-
Na+ + Cl-
H2O
.
NaCl
NaOH
HCl
1.
2.
Слайд 17Na+ + Cl – + HOH ↔ Na+ + OH – + H+ + Cl –
Образуются сильные электролиты,
которые диссоциируют
pH=7, среда нейтральная
[H+] = [OH –]
Слайд 18Вывод.
Раствор соли, образованной сильным основанием и сильной кислотой имеет нейтральную среду,
Слайд 19Соли, образованные слабым основанием и слабой летучей кислотой, подвергаются необратимому гидролизу,
Гидролиз таких солей может одновременно идти и по катиону ,и по аниону. Главное условие необратимости процесса- это то, что хотя бы один из продуктов должен выходить из сферы реакции.