- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Гидролиз солей 11 класс
Содержание
- 1. Презентация по химии на тему Гидролиз солей 11 класс
- 2. «ГИДРОЛИЗ» - от греческого - «гидро» - вода «лизис» - разложение
- 3. Гидролиз – это реакция обменного разложения веществ
- 4. Гидролиз солейСущность гидролиза сводится к обменному химическому
- 5. Классификация солей.Любую соль можно представить как продукт
- 6. KNO2 = K+ +
- 7. Соли, образованные сильным основанием и слабой кислотой.
- 8. Гидролиз солей, образованных слабым основанием и сильной
- 9. Соли, образованные сильной кислотой и слабым основанием.NH4Cl
- 10. Гидролиз солей, образованных слабым основанием и слабой
- 11. Соли, образованные слабой кислотой и слабым основанием.
- 12. Гидролиз солей, образованных сильным основанием и сильной
- 13. Соли, образованные сильной кислотой и сильным
- 14. Гидролиз солей.Гидролиз можно усилить:Добавить воды.Нагреть раствор (увеличится
- 15. Гидролиз солей.Гидролиз можно подавить.Увеличить концентрацию растворённого вещества.Охладить
- 16. Роль гидролиза
- 17. Преобразование земной коры
- 18. Обеспечение слабощелочной среды морской воды
- 19. Порча производственного оборудования
- 20. Очистка промышленных стоков и питьевой воды
- 21. Известкование почв основано на гидролизе
- 22. Подготовка тканей к окрашиванию
- 23. Выработка из непищевого сырья ценных продуктов (бумага, мыло, спирт, глюкоза, белковые дрожжи)
- 24. Бумага
- 25. Бумага
- 26. Бумага
- 27. Бумага
- 28. Мыло
- 29. Мыло
- 30. Спирт
- 31. Глюкоза
- 32. Белковые дрожжи
«ГИДРОЛИЗ» - от греческого - «гидро» - вода «лизис» - разложение
Слайд 3Гидролиз – это реакция обменного разложения веществ водой
Частицы растворенного вещества в
воде окружены гидратной оболочкой. В некоторых случаях это приводит к химическому взаимодействию с образованием новых веществ, к реакции гидролиза
Слайд 4Гидролиз солей
Сущность гидролиза сводится к обменному химическому взаимодействию катионов или анионов
соли с молекулами воды. В результате образуется слабый электролит.
Любая соль – это продукт взаимодействия основания с кислотой. В зависимости от силы основания и кислоты выделяют 4 типа солей.
Любая соль – это продукт взаимодействия основания с кислотой. В зависимости от силы основания и кислоты выделяют 4 типа солей.
Слайд 5Классификация солей.
Любую соль можно представить как продукт взаимодействия основания с кислотой.
В
зависимости от силы основания и кислоты можно выделить 4 типа солей:
1. Соли, образованные сильным основанием и слабой кислотой (КСN, NaCH3COO).
2. Соли, образованные сильной кислотой и слабым основанием (СuCl2, FeSO4, Mn(NO3)2.
3. Соли, образованные слабой кислотой и
слабым основанием
(NH4CN, Cu(CH3COO)2).
4. Соли, образованные сильной кислотой и сильным основанием
(NaCl, K2SO4, BaI2).
1. Соли, образованные сильным основанием и слабой кислотой (КСN, NaCH3COO).
2. Соли, образованные сильной кислотой и слабым основанием (СuCl2, FeSO4, Mn(NO3)2.
3. Соли, образованные слабой кислотой и
слабым основанием
(NH4CN, Cu(CH3COO)2).
4. Соли, образованные сильной кислотой и сильным основанием
(NaCl, K2SO4, BaI2).
Слайд 6
KNO2 = K+ + NO2-
H2O =
OH- + H+
KNO2 + H2O = KOH + HNO2
K+ + NO2- + H2O = K+ + OH- + HNO2
NO2- + H2O = OH- + HNO2
KNO2 + H2O = KOH + HNO2
K+ + NO2- + H2O = K+ + OH- + HNO2
NO2- + H2O = OH- + HNO2
Гидролиз солей, образованных сильным основанием и слабой кислотой
Слайд 7Соли, образованные сильным основанием и слабой кислотой.
NaCN + Н2О ↔
NaOH + HCN
NaCN ↔Na+ + CN‾
Н2О ↔ OH ‾ + H+
Полное ионное уравнение гидролиза:
Na+ + CN¯ + Н2О ↔ Na+ + OH¯ + HCN
Сокращённое уравнение гидролиза:
CN¯ + Н2О ↔ OH¯ + HCN
рн >7, среда щелочная, гидролиз по аниону.
NaCN ↔Na+ + CN‾
Н2О ↔ OH ‾ + H+
Полное ионное уравнение гидролиза:
Na+ + CN¯ + Н2О ↔ Na+ + OH¯ + HCN
Сокращённое уравнение гидролиза:
CN¯ + Н2О ↔ OH¯ + HCN
рн >7, среда щелочная, гидролиз по аниону.
Слайд 8
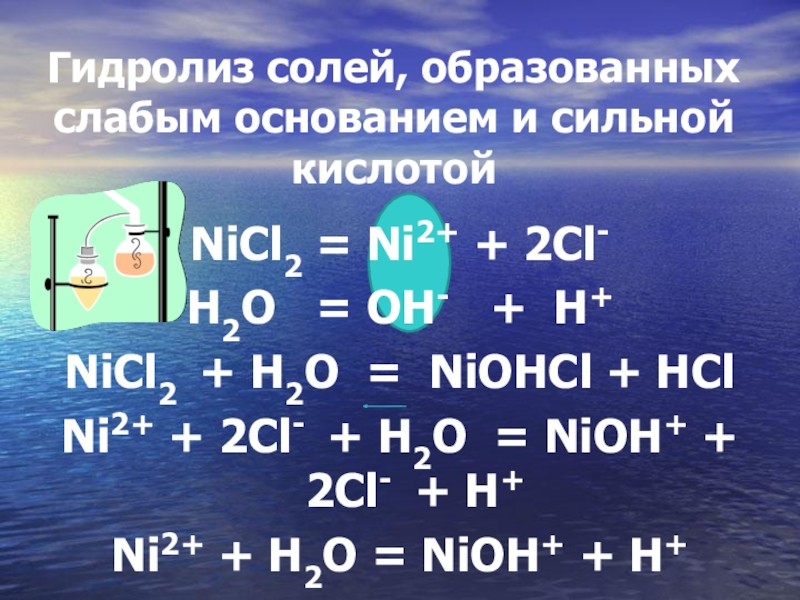
Гидролиз солей, образованных слабым основанием и сильной кислотой
NiCl2 = Ni2+
+ 2Cl-
H2O = OH- + H+
NiCl2 + H2O = NiOHCl + HCl
Ni2+ + 2Cl- + H2O = NiOH+ + 2Cl- + H+
Ni2+ + H2O = NiOH+ + H+
H2O = OH- + H+
NiCl2 + H2O = NiOHCl + HCl
Ni2+ + 2Cl- + H2O = NiOH+ + 2Cl- + H+
Ni2+ + H2O = NiOH+ + H+
Слайд 9Соли, образованные сильной кислотой и слабым основанием.
NH4Cl + H2O ↔ NH3·H2О
+ НСl
NH4Cl ↔ NH4+ + Cl¯
Н2О ↔ OH¯ + H+
Полное ионное уравнение гидролиза:
NH4+ + Cl¯ + Н2О ↔ NH3 · H2О + H+ + Cl¯
Сокращённое уравнение гидролиза:
NH4+ + Н2О ↔ NH3 · H2О + H+
рн <7, среда кислотная, гидролиз по
катиону.
NH4Cl ↔ NH4+ + Cl¯
Н2О ↔ OH¯ + H+
Полное ионное уравнение гидролиза:
NH4+ + Cl¯ + Н2О ↔ NH3 · H2О + H+ + Cl¯
Сокращённое уравнение гидролиза:
NH4+ + Н2О ↔ NH3 · H2О + H+
рн <7, среда кислотная, гидролиз по
катиону.
Слайд 10
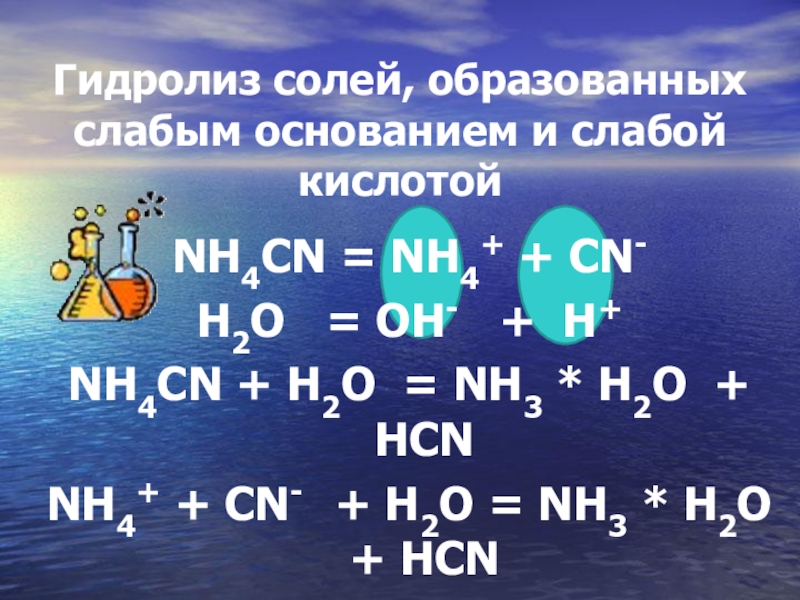
Гидролиз солей, образованных слабым основанием и слабой кислотой
NH4CN = NH4+
+ CN-
H2O = OH- + H+
NH4CN + H2O = NH3 * H2O + HCN
NH4+ + CN- + H2O = NH3 * H2O + HCN
H2O = OH- + H+
NH4CN + H2O = NH3 * H2O + HCN
NH4+ + CN- + H2O = NH3 * H2O + HCN
Слайд 11Соли, образованные слабой кислотой и слабым основанием.
NH4СН3СОО + H2O ↔
СН3СООН + NH3 · H2О
NH4СН3СОО ↔ NH4 + + СН3СОО¯
Н2О ↔ OH¯ + H +
Ионное уравнение гидролиза:
NH4 + + СН3СОО¯ + Н2О ↔ NH3 · H2О + СН3СООН
рн = 7, среда нейтральная, гидролиз по
катиону и по аниону.
NH4СН3СОО ↔ NH4 + + СН3СОО¯
Н2О ↔ OH¯ + H +
Ионное уравнение гидролиза:
NH4 + + СН3СОО¯ + Н2О ↔ NH3 · H2О + СН3СООН
рн = 7, среда нейтральная, гидролиз по
катиону и по аниону.
Слайд 12Гидролиз солей, образованных сильным основанием и сильной кислотой
KCl = K+
+ Cl-
H2O = OH- + H+
KCl + H2O = KOH + HCl
K+ + Cl- + H2O = K+ + Cl- + OH- + H+
H2O = OH- + H+
H2O = OH- + H+
KCl + H2O = KOH + HCl
K+ + Cl- + H2O = K+ + Cl- + OH- + H+
H2O = OH- + H+
Слайд 13
Соли, образованные сильной кислотой и сильным основанием.
КСl + H2O ↔
КСl ↔ К + + Сl¯
Н2О ↔ OH¯ + H +
Все ионы остаются в растворе – гидролиз не происходит. Среда нейтральная, рН =7, т.к.
концентрации катионов водорода и гидроксид - анионов в растворе равны, как в чистой воде.
КСl ↔ К + + Сl¯
Н2О ↔ OH¯ + H +
Все ионы остаются в растворе – гидролиз не происходит. Среда нейтральная, рН =7, т.к.
концентрации катионов водорода и гидроксид - анионов в растворе равны, как в чистой воде.
Слайд 14Гидролиз солей.
Гидролиз можно усилить:
Добавить воды.
Нагреть раствор (увеличится диссоциация воды).
Связать один из
продуктов гидролиза в труднорастворимое соединение или удалить один из продуктов в газовую фазу.
Слайд 15Гидролиз солей.
Гидролиз можно подавить.
Увеличить концентрацию растворённого вещества.
Охладить раствор.
Ввести в раствор один
из продуктов гидролиза: подкислять (если рН <7) или подщелачивать (если рН>).
Слайд 23
Выработка из непищевого сырья ценных продуктов (бумага, мыло, спирт, глюкоза, белковые
дрожжи)