- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Гидролиз солей
Содержание
- 1. Презентация по химии на тему: Гидролиз солей
- 2. План лекции:1. Понятие о гидролизе солей. Степень гидролиза 2. Гидролиз солей различных типовГидролиз солей
- 3. 1. Понятие о гидролизе. Степень гидролизаИсследуем действие универсального индикатора на растворы некоторых солейNaClMgCl2Na2CO3Таблица 1
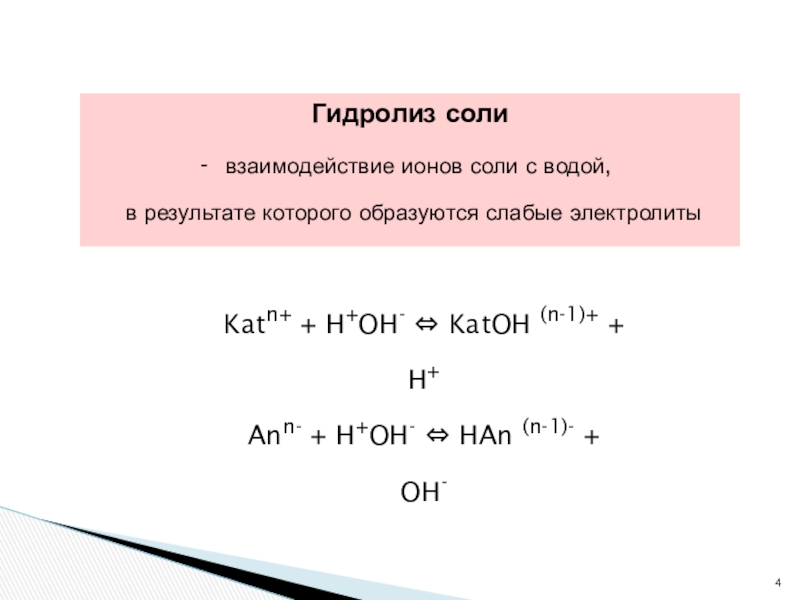
- 4. Гидролиз соли взаимодействие ионов соли с
- 5. Степень гидролиза h отношение числа гидролизованных молекул
- 6. Соли1. Образованы сильным основанием и сильной кислотой
- 7. Сильные электролиты (α → 1 или
- 8. 1. Рассмотреть состав соли, определить к какому
- 9. KNО2 ↔ K+ + NО2-
- 10. Соль образована сильным основанием и слабой кислотой
- 11. В случае, если соль образованна слабой многоосновной
- 12. NH4+ + H+OH- ↔ NH4OH + H+
- 13. Zn(NO3)2 ↔ Zn2+ + 2NO3-
- 14. В случае, если соль образованна слабым многокислотным
- 15. CH3COONH4 + H+OH- ↔ CH3COOH +
- 16. Соли, образованные слабым нерастворимым или летучим основанием
- 17. Изменение цвета индикаторов в различных средахгидролиз
- 18. Константы диссоциации некоторых слабых электролитовв водных растворах (250С)назад
- 19. Литература 1. Егоров А.С. Химия, Пособие-репетитор, Феникс,
Слайд 2План лекции:
1. Понятие о гидролизе солей. Степень гидролиза
2. Гидролиз солей
Гидролиз солей
Слайд 31. Понятие о гидролизе. Степень гидролиза
Исследуем действие универсального индикатора
на растворы
NaCl
MgCl2
Na2CO3
Таблица 1
Слайд 4Гидролиз соли
взаимодействие ионов соли с водой,
в результате которого
Katn+ + H+OH- KatOH (n-1)+ + H+
Ann- + H+OH- HAn (n-1)- + OH-
Слайд 5Степень гидролиза h
отношение числа гидролизованных молекул
к общему числу
h = n / N ∙ 100%,
где n – число молекул соли, подвергшихся гидролизу
N - общее число растворенных молекул соли.
Степень гидролиза h зависит от
природы соли
концентрации раствора. При разбавлении раствора h ↑
температуры. При повышении температуры h ↑
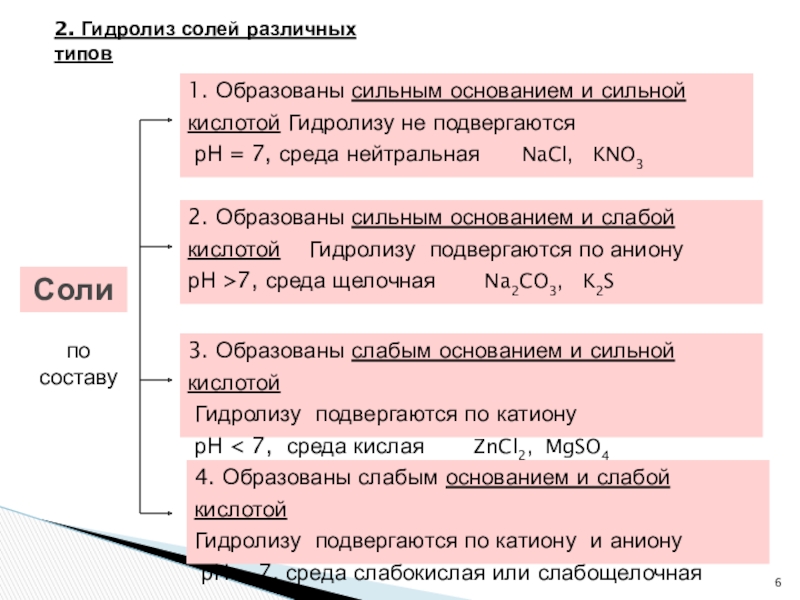
Слайд 6Соли
1. Образованы сильным основанием и сильной кислотой Гидролизу не подвергаются
2. Образованы сильным основанием и слабой кислотой Гидролизу подвергаются по аниону
рН >7, среда щелочная Na2CO3, K2S
3. Образованы слабым основанием и сильной кислотой
Гидролизу подвергаются по катиону
рН < 7, среда кислая ZnCl2, MgSO4
4. Образованы слабым основанием и слабой кислотой
Гидролизу подвергаются по катиону и аниону
рН ~ 7, среда слабокислая или слабощелочная
по составу
2. Гидролиз солей различных типов
Слайд 7 Сильные электролиты (α → 1 или 100%)
1) сильные кислоты (H2SO4,
2) щелочи (NaOH, KOH, LiOH, Ba(OH)2, Ca(OH)2 и др.)
Слабые электролиты (α → 0)
1) cлабые кислоты (H2S, H2CO3, H2SiO3, HNO2, H3PO4, H2SO3, HCN, HF, CH3COOH и др.)
2) нерастворимые в воде основания (Cu(OH)2, Fe(OH)3 и др.)
3) гидроксид аммония NH4OH
Слайд 81. Рассмотреть состав соли, определить к какому типу солей по составу
относится.
2. Записать уравнение диссоциация соли (распада на ионы)
3. Записать уравнение гидролиза иона, соответствующего слабому основанию или слабой кислоте.
4. Определить среду раствора (рН)
5. Записать уравнение гидролиза в молекулярной форме.
Алгоритм составления уравнений гидролиза солей
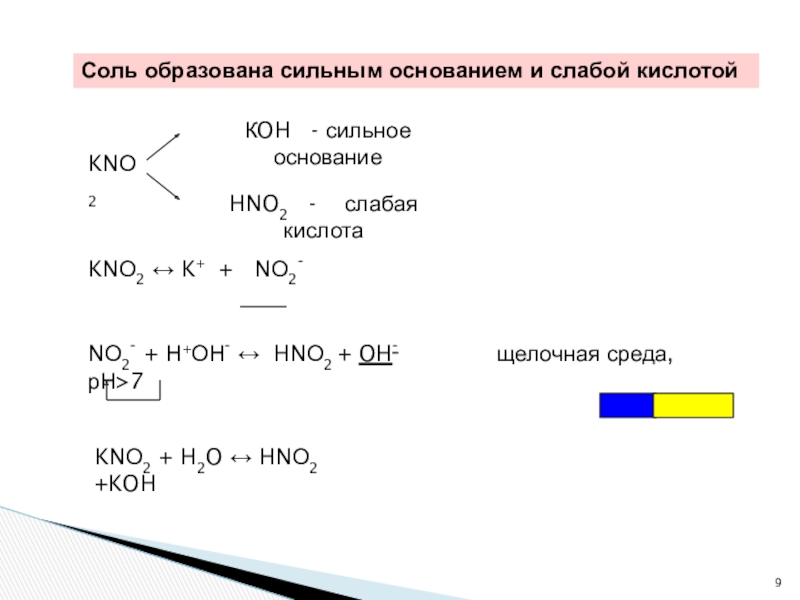
Слайд 9KNО2 ↔ K+ + NО2-
NО2- + Н+ОН- ↔ HNО2 + OH- щелочная среда, рН7
КOH - сильное основание
HNO2 - слабая кислота
KNО2
KNО2 + H2O ↔ HNО2 +KOH
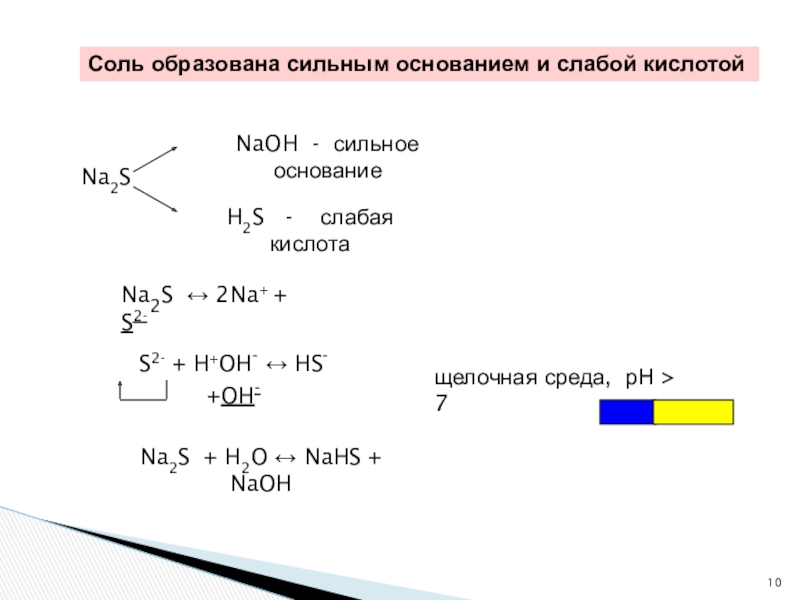
Соль образована сильным основанием и слабой кислотой
Слайд 11В случае, если соль образованна слабой многоосновной кислотой, гидролиз протекает ступенчато.
2
! Гидролиз средних солей многоосновных кислот приводит к образованию кислых солей.
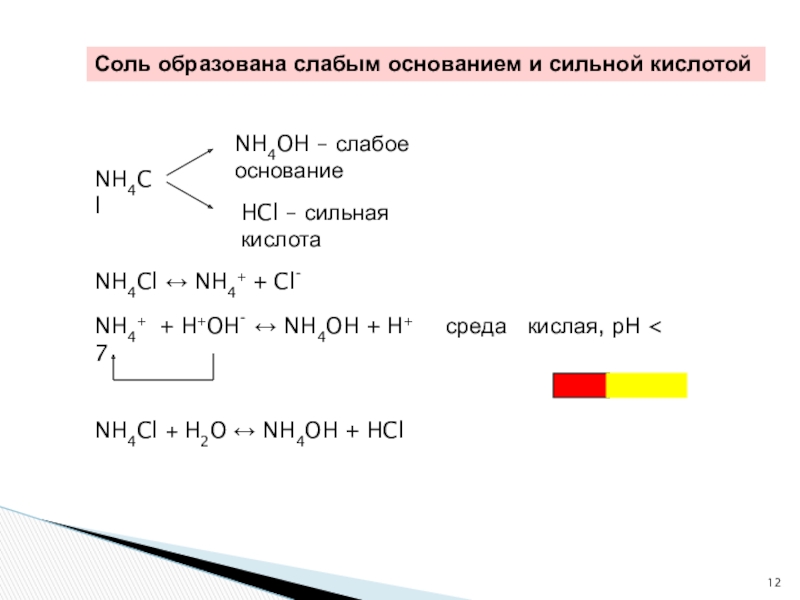
Слайд 12NH4+ + H+OH- ↔ NH4OH + H+ среда
NH4Cl
NH4OH – слабое основание
HCl – сильная кислота
NH4Cl ↔ NH4+ + Cl-
NH4Cl + H2O ↔ NH4OH + HCl
Соль образована слабым основанием и сильной кислотой
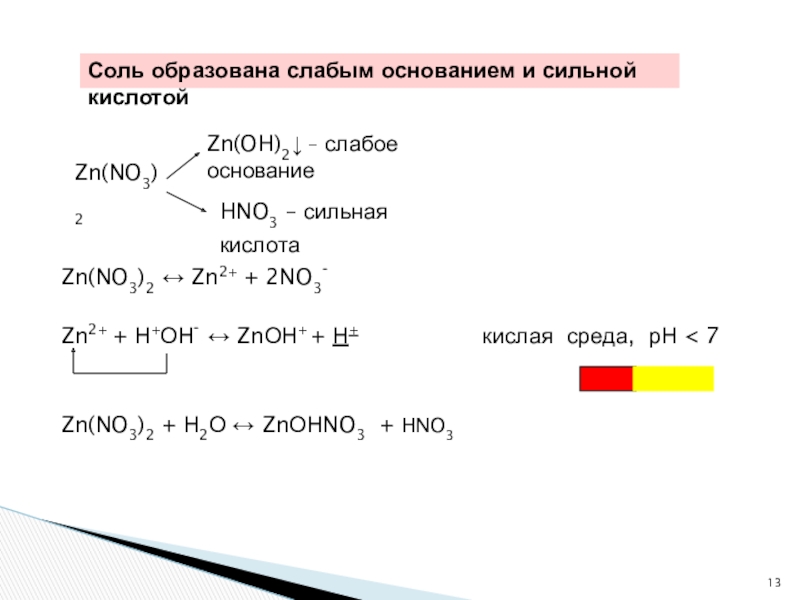
Слайд 13Zn(NO3)2 ↔ Zn2+ + 2NO3-
Zn2+ + Н+ОН- ↔ ZnОН+ + Н+ кислая среда, рН < 7
Zn(NO3)2
Zn(OH)2↓ – слабое основание
HNO3 – сильная кислота
Zn(NO3)2 + Н2О ↔ ZnОНNO3 + HNO3
Соль образована слабым основанием и сильной кислотой
Слайд 14В случае, если соль образованна слабым многокислотным основанием, гидролиз протекает
2 ступень: ZnОН+ + Н+ОН- ↔ Zn(ОН)2 + Н+
! Гидролиз средних солей многокислотных оснований приводит к образованию основных солей.
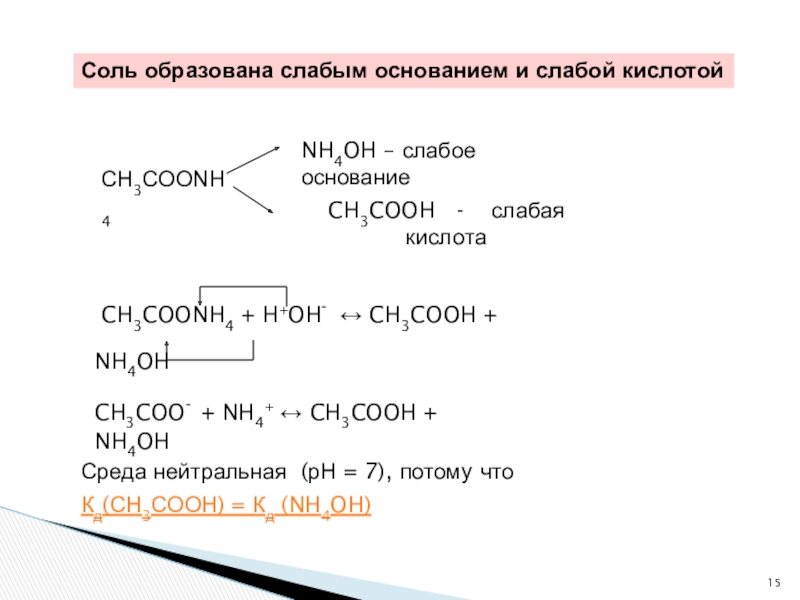
Слайд 15 CH3COONH4 + H+OH- ↔ CH3COOH + NH4OH
СН3СООNH4
CH3COOH -
NH4OH – слабое основание
Соль образована слабым основанием и слабой кислотой
CH3COO- + NH4+ ↔ CH3COOH + NH4OH
Среда нейтральная (рН = 7), потому что
Кд(СН3СООН) = Кд (NH4OH)
Слайд 16Соли, образованные слабым нерастворимым или летучим основанием и слабой нерастворимой или
Al2S3+ 3H2O = 2 Al(OH)3↓ +3H2S↑
Al2S3
H2S - слабая кислота
Al (OH)3↓ – слабое основание
Соль образована слабым основанием и слабой кислотой
Слайд 19Литература
1. Егоров А.С. Химия, Пособие-репетитор, Феникс, 1999, раздел 5, §
2. Ерохин Ю.М. Химия, М, 2001, гл.6, $ 2-4
3. Габриелян О.С., Лысова Г.Г. Химия, 11 класс, гл.3, § 15 - 16