- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Галогены
Содержание
- 1. Презентация по химии на тему Галогены
- 2. Слайд 2
- 3. Свойства элементовРастет: радиус атома, металлические свойстваУменьшается: распространенность в природе, электроотрицательность
- 4. Содержание в живом организме и биологическое действие
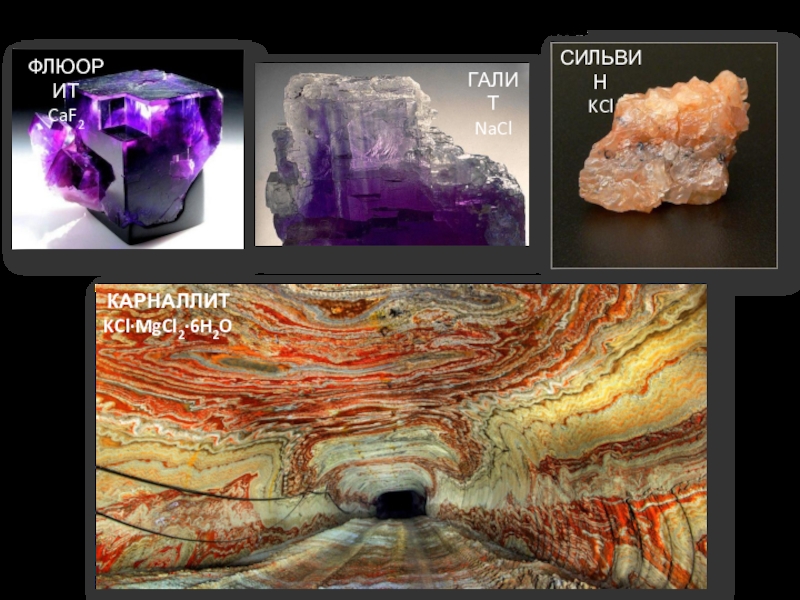
- 5. Галогенсодержащие минералыГАЛИТNaClСИЛЬВИНKClКАРНАЛЛИТKCl·MgCl2·6H2OФЛЮОРИТCaF2
- 6. Простые вещества – двухатомные молекулы, обладающие
- 7. Растворы йода в различных растворителях:доказательство эффекта сольватации,
- 8. Простые вещества – двухатомные молекулы, обладающие окислительными свойствами
- 9. Галогенид-анионыРастет: радиус аниона, восстановительные свойстваПадает: полярность и
- 10. Галогенид-ионы
- 11. Свойства галогенид-ионов
- 12. Кислородные соединения галогенов
- 13. Кислородные кислоты галогеновРастет: сила и устойчивость кислотыУменьшается:
- 14. Слайд 14
- 15. Все элементы существуют в виде 2-х атомных
Слайд 3Свойства элементов
Растет: радиус атома, металлические свойства
Уменьшается: распространенность в природе, электроотрицательность
Слайд 6Простые вещества
– двухатомные молекулы, обладающие окислительными свойствами
Растет: длина связи Г-Г,
Падает: окислительная активность, прочность связи, устойчивость к нагреванию
Слайд 7Растворы йода в различных растворителях:
доказательство эффекта сольватации, чем менее фиолетовый, тем
В воде растворяются плохо.
Йод – практически нерастворим. Растворимость йода в воде увеличивается при добавлении KI за счет образования прочного комплекса KI3:
KI + I2 = KI3.
Растворимость галогенов можно увеличить, если использовать малополярные органические растворители — бензол C6H6, четыреххлористый углерод CCl4, поскольку молекулы галогенов неполярны, а подобное растворяется в подобном!
Растворы галогенов
Слайд 9Галогенид-анионы
Растет: радиус аниона, восстановительные свойства
Падает: полярность и прочность связи H-Г, устойчивость
Растет: сила кислоты, температура кипения растворов
Слайд 13Кислородные кислоты галогенов
Растет: сила и устойчивость кислоты
Уменьшается: сила окислителя, длина связи
Основной процесс – смещение электронной плотности по кратной связи Cl=O ⇒ ослабление связи О-Н ⇒
легкое отщепление протона: диссоциация
Слайд 15Все элементы существуют в виде 2-х атомных молекул.
Проявляют свойства типичных
Галогены – окислители. Окислительная способность падает вниз по группе.
Стабильность НХ падает вниз по группе. Для HF характерны наиболее прочные водородные связи.
Кислородные соединения характеры для Cl, Br, I. Максимальная с.о. равна +7.
Наиболее стабильны с.о. -1 и +5.
Сила кислородных кислот уменьшается вниз по группе.
Общие закономерности