- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Фосфор
Содержание
- 1. Презентация по химии на тему Фосфор
- 2. Цель урока:Формирование знаний о химическом элементе и
- 3. ПЛАН УРОКА:1.Проверка домашнего заданияУстная проверка письменного домашнего
- 4. Актуализация знаний 1.Фронтальный устный опрос Какие
- 5. Слайд 5
- 6. Обобщение новой темы:1.СТРОЕНИЕ АТОМА ФОСФОРАAr=31V группа, главная
- 7. АЛЛОТРОПНЫЕ МОДИФИКАЦИИ ФОСФОРА
- 8. ХИМИЧЕСКИЕ СВОЙСТВА ФОСФОРАСвойства восстановителя:а)При избытке кислорода фосфор
- 9. РАСПРОСТРАНЕНИЕ В ПРИРОДЕ В природе фосфор
- 10. ПРИМЕНЕНИЕ ФОСФОРАВ XIX веке фосфор применялся ирландскими борцами за
- 11. Домашнее заданиеПараграф 20-учить,№6-9 –письменно –первый уровень,10 тестовых задач –второй уровень
- 12. Ресурсы:.Химия 9: Учебник для 9 классов
Слайд 1Предмет: химия
Тема «Фосфор»
9 класс
СПЕЦИАЛИЗИРОВАННЫЙ ЛИЦЕЙ
«АРЫСТАН»
УЧИТЕЛЬ ХИМИИ ШАМГАНОВА Т.С.
Слайд 2Цель урока:
Формирование знаний о химическом элементе и простом веществе фосфоре; строении
Слайд 3ПЛАН УРОКА:
1.Проверка домашнего задания
Устная проверка письменного домашнего задания
Химический диктант
2.Актуализация знаний:
Фронтальный опрос
3.Изучение
Самостоятельная изучение нового материала по учебнику, ЦОР
Работа в тетради
4. Закрепление материала:
работа по тетради на печатной основе
5.Обобщение по презентации
6.Домашнее задание
7.Выставление оценок, подведение итогов урока
8.Рефлексия
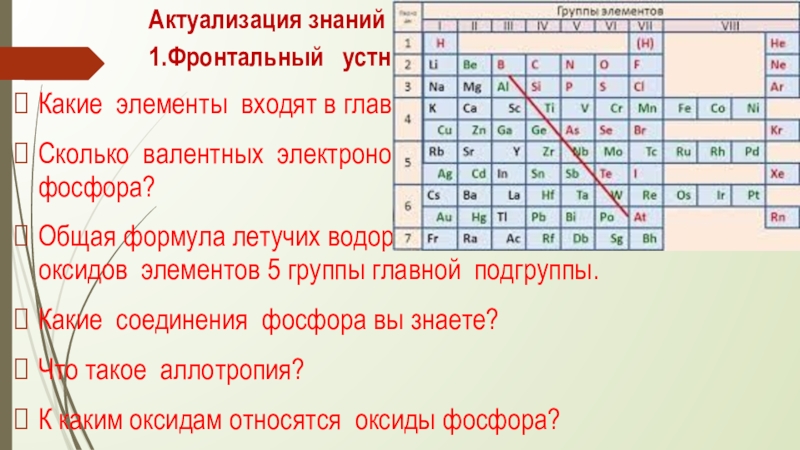
Слайд 4Актуализация знаний
1.Фронтальный устный опрос
Какие элементы входят в главную подгруппу 5
Сколько валентных электронов имеется в атомах азота и фосфора?
Общая формула летучих водородных соединений, высших оксидов элементов 5 группы главной подгруппы.
Какие соединения фосфора вы знаете?
Что такое аллотропия?
К каким оксидам относятся оксиды фосфора?
Слайд 5
Задание №1: проставьте степень окисления всех элементов в соединениях
Al(NO3)3 HNO2 Ba3(PO4)2 N2O P2O5 NO2
HNO3 NH3 P2O3 H3PO4 N2O5 KNO3 N2O3
Задание №2: дописать уравнения химических реакций:
P2O5 + H2O CO2+ H2O
SO2+O2 CO2+BaO
NaOH+ P2O5
Составить электронный баланс к одному из уравнений
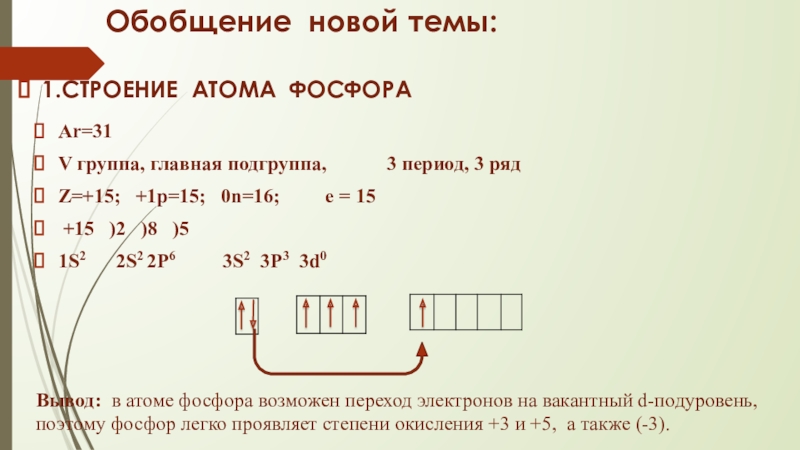
Слайд 6Обобщение новой темы:
1.СТРОЕНИЕ АТОМА ФОСФОРА
Ar=31
V группа, главная подгруппа,
Z=+15; +1p=15; 0n=16; e = 15
+15 )2 )8 )5
1S2 2S2 2P6 3S2 3P3 3d0
Вывод: в атоме фосфора возможен переход электронов на вакантный d-подуровень, поэтому фосфор легко проявляет степени окисления +3 и +5, а также (-3).
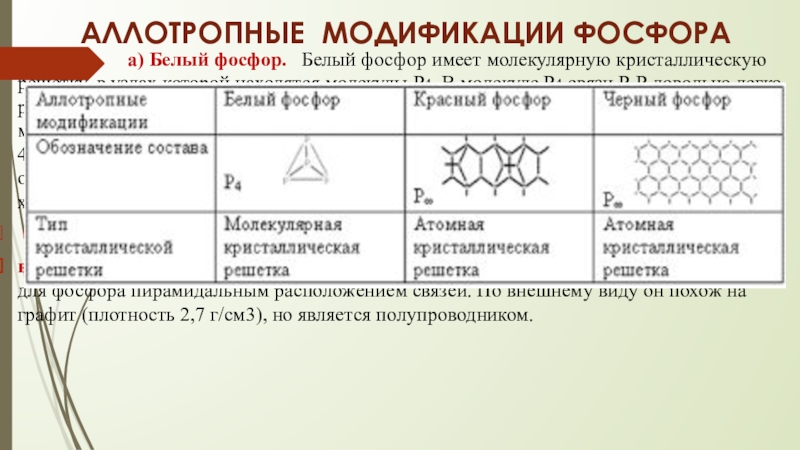
Слайд 7АЛЛОТРОПНЫЕ МОДИФИКАЦИИ ФОСФОРА
б) Красный фосфор. Не опасен, при нагревании воспламеняется
в) Чёрный фосфор. Черный фосфор имеет атомно-слоистую решетку с характерным для фосфора пирамидальным расположением связей. По внешнему виду он похож на графит (плотность 2,7 г/см3), но является полупроводником.
Слайд 8ХИМИЧЕСКИЕ СВОЙСТВА ФОСФОРА
Свойства восстановителя:
а)При избытке кислорода фосфор окисляется до оксида фосфора
4P + 5O2 = 2P2O5 4P + 3O2 = 2P2O3
б)2P + 3Cl2 = 2PCl3
в)2P + 3S = P2S3, (в сероуглероде),
Свойства окислителя:
д) 2P (красн.) + 3Ca = +2Ca3P2 (фосфид) , при t=400 °C.
е) 2P + 3H2 = 2PH3 (фосфин), (t=300-360 °C),
Соединения фосфора:
Оксиды фосфора (3), (5), фосфорная кислота,
Слайд 9РАСПРОСТРАНЕНИЕ В ПРИРОДЕ
В природе фосфор встречается в виде сложных веществ
В Казахстане
месторождение в горах Каратау (Жамбылская область), месторождение Шилисай в Актюбинской области;
фосфорные заводы: Тараз, Шымкент, Актюбинская область
Слайд 10ПРИМЕНЕНИЕ ФОСФОРА
В XIX веке фосфор применялся ирландскими борцами за независимость в борьбе против
Фосфорные боеприпасы (в том числе, ракеты, ручные гранаты, артиллерийские снаряды и авиабомбы) применялись во время первой мировой войны
так, немцы использовали зажигательные ракеты (получившие у солдат неофициальное название «Brennende Zwiebel»), но широкого распространения они не получили
снаряженные фосфором артиллерийские снаряды имели более широкое применение, но не являлись единственным типом зажигательных снарядов
в 1916 году на вооружение британских войск поступили зажигательные гранаты, снаряжённые белым фосфором.
В 2009 году в ходе операции «Литой свинец» израильская армия использовала фосфорные боеприпасы в секторе Газа. В основном, применялись 155-мм снаряды с белым фосфором, по меньшей мере один раз использовались миномётные мины. Позднее МИД Израиля выступило с заявлением, что в секторе Газа израильская армия применяла дымовые боеприпасы, содержащие белый фосфор, допускаемые международным законодательством при применении против военных объектов.
В 2009—2012 годы палестинские террористы, обстреливающие территорию Израиля из сектора Газа, в ряде случаев применяли ракеты, снаряженные белым фосфором
Слайд 11Домашнее задание
Параграф 20-учить,
№6-9 –письменно –первый уровень,
10 тестовых задач –второй уровень
Слайд 12Ресурсы:
.Химия 9: Учебник для 9 классов общеобразовательной школы/ Н.Н.Нурахметов,К.А.Сарманова, К.М.Джексембина,
2.Химия 9: Методическое руководство. Пособие для учителей 9 классов общеобразовательных школ/Н.Нугуманов, Р.Жумадилова. Алматы: Мектеп, 2013
3.Химия: Рабочая тетрадь. Учебное пособие для 9 класса общеобразовательных школ-2 издание /Н.Н.Нурахметов, Н.А.Заграничная- Алматы: издательство «Мектеп», 2013
4.Химия: Сборник задач и упражнений по химии. Учебное пособие для 9 класса общеобразовательных школ-2 издание /А.Е.Темирбулатова- Алматы: издательство «Мектеп», 2009
5.Презентация «Фосфор и его соединения»
6.Периодическая таблица химических элементов Д.И.Менделеева
7.ЦОР
8.Интерактивный тест «Фосфор»
9.опережающее задание-сообщение лицеиста
10.РеактивыСправочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2.
11.Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0