- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Фосфор
Содержание
- 1. Презентация по химии на тему Фосфор
- 2. «…Да! Это была собака, огромная, черная, как
- 3. ПО СЛЕДАМХИМИЯ 9 КЛАССфосфора
- 4. Фосфор
- 5. Общая характеристика фосфораФосфор- элемент V группы, главной
- 6. Хеннинг Бранд,1669 г Роберт БойльФосфор, в переводе с греческого «phosphoros» означает «светоносец»
- 7. История открытия и изучения фосфора Г. Лейбниц
- 8. Р31+150)))p+= 15e¯ = 15n°= 15Электронное строениеВалентные возможности2851s22s22p63s23p53d°Валентные
- 9. Аллотропия фосфора
- 10. Белый фосфорБелый фосфор самовозгорается на воздухе.
- 11. Слайд 11
- 12. ЗАДАНИЕ 1Определите степени окисления фосфора в следующих
- 13. Нахождение в природеСодержание в земной коре –
- 14. Фосфор в природеНа долю фосфора приходится 0,08%
- 15. ЗАДАНИЕ 2
- 16. ХИМИЧЕСКИЕ СВОЙСТВАФосфор может реагировать со многими неметаллами:
- 17. Взаимодействие с металлами. При нагревании фосфора
- 18. Взаимодействие со щелочами. При нагревании белого
- 19. Сильные окислители превращают фосфор в фосфорную кислоту:
- 20. Реакция окисления также происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
- 21. ЗАДАНИЕ 3Расставьте коэффициенты в ОВР: P + KClO3 => P2O5 + KCl
- 22. Содержание фосфора в организме человекаВ тканях мозга
- 23. АТФДНКРНК
- 24. " Элемент жизни и мысли "Если
- 25. ЗАДАНИЕ 4Массовая доля костей человека составляет 20%
- 26. Получение фосфорафосфат кальция Ca3(PO4)2электропечьбелый фосфор(желтый фосфор)2Ca3(PO4)2 + 6SiO2 + 10C = 6CaSiO3 + P4 + 10CO
- 27. Применение фосфораР Р Р Простой суперфосфат,
- 28. Двойной суперфосфат Ca3(PO4)2 + 4H3PO4 = 3Ca(H2O4)2
- 29. Оружие массового поражения
- 30. ТЕСТ1. В каком из перечисленных соединений степень
- 31. Шерлок Холмс: «Фосфор! Странная смесь…Совершенно без запаха. Состав преступления теперь налицо…»
- 32. Прав ли былАртур Конан-Дойл?
- 33. А. Е. ФерсманМечтая раздобыть свой философский камень,
- 34. Домашнее задание §20, стр.98 упр.6,8 Сообщение «История открытия спичек»
- 35. РЕФЛЕКСИЯНа уроке было комфортно и все понятноНа
- 36. СПАСИБО ЗА УРОК!
Слайд 2«…Да! Это была собака, огромная, черная, как смоль… Из ее отверстной
К. Дойл
Прав ли был Конан Дойль?
Слайд 5Общая характеристика фосфора
Фосфор- элемент V группы, главной подгруппы.
Заряд ядра атома фосфора
В ядре атома фосфора 15 протонов.
В ядре атома фосфора 16 нейтронов.
В атоме фосфора 15 электронов.
Атом фосфора имеет 3 энергетических уровня.
Электронная оболочка имеет строение 2е, 8е, 5е.
На внешнем уровне в атоме элемента 5 электронов.
Высшая степень окисления атома фосфора равна +5 .
Простое вещество является неметаллом.
Высший оксид и гидроксид фосфора имеют кислотный характер.
5
Слайд 6 Хеннинг Бранд,1669 г
Роберт Бойль
Фосфор, в переводе с греческого «phosphoros»
Слайд 7История открытия и изучения фосфора
Г. Лейбниц
Купил секрет
получения фосфора
Р.
В 1680 г.
получил фосфор
Независимо от Бранда
Слайд 8Р
31
+15
0
)))
p+= 15
e¯ = 15
n°= 15
Электронное строение
Валентные возможности
2
8
5
1s2
2s2
2p6
3s2
3p5
3d°
Валентные возможности -
Краткая электронная
III, V
3s23p5
Строение атома фосфора
Слайд 10 Белый фосфор
Белый фосфор самовозгорается на воздухе. Кроме того, процесс окисления
Доза фосфора в 0,05-0,15 г для человека смертельна. Профессиональное заболевание рабочих спичечных фабрик был фосфорный некроз – поражение челюстей. Белый фосфор не только сильный яд, при попадании на кожу вызывает долго не заживающие ожоги.
Слайд 11 Красный фосфор
Не растворяется
Не ядовит и не светится в темноте.
Белый фосфор
Слайд 12ЗАДАНИЕ 1
Определите степени окисления фосфора в следующих соединениях:
P2O3, PCl3, K3P, P2S3,
Слайд 13Нахождение в природе
Содержание в земной коре – 0,08%. В природе фосфор
Важнейшее из них – фосфат кальция – минерал апатит, наиболее распространен фторапатит
3Ca3(PO4)2 CаF2
Разновидности апатита слагают осадочные горные породы – фосфориты.
Апатит
ФОСФОРИТ
Слайд 14Фосфор в природе
На долю фосфора приходится 0,08% веса земной коры. Фосфор
В растениях фосфор содержится в основном в плодах, семенах.
В организме животных, птиц, рыб – в скелете и нервной ткани.
В теле человека содержится около 1,5 кг фосфора, из которых 1,4 кг приходится на кости.
Слайд 15ЗАДАНИЕ 2
1. P →P2O5→HPO3→H3PO4→K3PO4
2. P→P2S5→P2O5→H3PO4→NH4H2PO4→HPO3
3. P→Ca3P2→PH3→P2O5→Na3PO4→Ag3PO4
4.PH3→H3PO4→H4P2O7→HPO3→H3PO4→(NH4)2HPO4
5. Ca3(PO4)2→P→P2O3→P2O5→Ca3(PO4)2→H3PO4
Слайд 16ХИМИЧЕСКИЕ СВОЙСТВА
Фосфор может реагировать со многими неметаллами: кислородом, серой, галогенами, с
2P + 3Cl2 = 2PCl3
4P + 5O2 = 2P2O5
(с избытком кислорода)
4P + 3O2 = 2P2O3
(при медленном окислении или при недостатке О2)
или 2P + 5Cl2 = 2PCl5
Слайд 17 Взаимодействие с металлами. При нагревании фосфора с металлами образуются фосфиды:
3Mg
Фосфиды некоторых металлов могут разлагаться водой с образованием газообразного
фосфина PH3:
Mg3P2 + 6H2O = 3Mg(OH)2 + 2PH3↑
Фосфин – очень ядовитый газ с неприятным запахом, легко воспламеняется на воздухе. Это свойство фосфина объясняет появление болотных блуждающих огней.
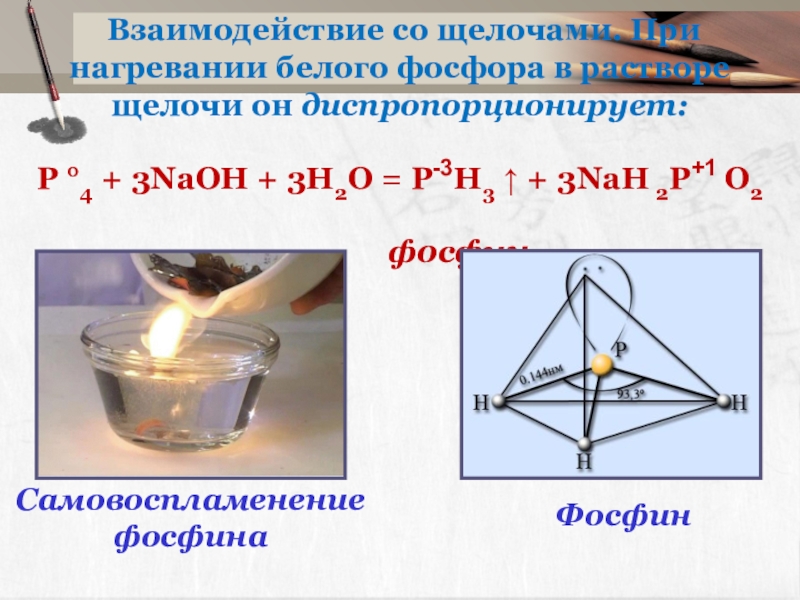
Слайд 18 Взаимодействие со щелочами. При нагревании белого фосфора в растворе щелочи
P °4 + 3NaOH + 3H2O = P-3H3 ↑ + 3NaH 2P+1 O2
фосфин
Самовоспламенение фосфина
Фосфин
Слайд 19Сильные окислители превращают фосфор в фосфорную кислоту:
3P° + 5HN+5O3 +
P° - 5 е- = P+5 восстановитель
(окисление)
N+5+8 е- = N+2 окислитель
(восстановление)
Взаимодействие фосфора с азотной кислотой
Слайд 20Реакция окисления также происходит при поджигании спичек, в качестве окислителя выступает
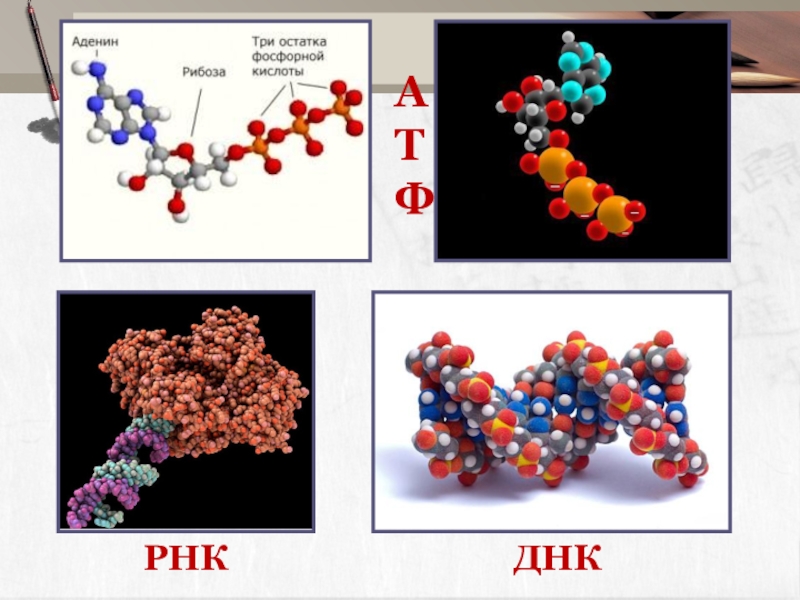
Слайд 22Содержание фосфора в организме человека
В тканях
мозга – 0,38 %.
В мышцах
В организме содержится 500-800 г фосфора.
До 85% его находится в костях и зубах.
Phosphorus
Слайд 24" Элемент жизни
и мысли "
Если бы фосфор исчез из костей,
Слайд 25ЗАДАНИЕ 4
Массовая доля костей человека составляет 20% от общей массы организма.
Слайд 26Получение фосфора
фосфат кальция
Ca3(PO4)2
электропечь
белый фосфор
(желтый фосфор)
2Ca3(PO4)2 + 6SiO2 + 10C =
Слайд 27 Применение фосфора
Р
Р
Р
Простой суперфосфат, основным компонентом которого является
Ca3(PO4)2 + 2H2SO4 = Ca(H2PO4)2 + 2CaSO4
Слайд 28Двойной суперфосфат
Ca3(PO4)2 + 4H3PO4 = 3Ca(H2O4)2
Вместе с азотом фосфор
Слайд 30ТЕСТ
1. В каком из перечисленных соединений степень окисления фосфора +3
2. В какой из приведенных пар оба вещества взаимодействуют с фосфором:
А) кальций и соляная кислота; Б) натрий и хлор; В) кислород и соляная кислота.
А
Б
В
3. Составьте уравнение реакции фосфора с кальцием. Коэффициент перед
формулой окислителя: А) 2; Б) 3); В) 1.
4. Как хранят красный фосфор в лаборатории:
А) под слоем воды; Б) под слоем керосина; В) в обычных условиях.
В
5. Фосфор образует простое вещество с молекулярной кристаллической решеткой,
в узлах которой находятся молекулы Р4. какой цвет имеет такой фосфор:
А) красный; Б) желтый; В) зеленый.
Б
6. Степень окисления фосфора увеличивается в ряду:
А) PH3, P2O3, H3PO4; Б) Na3PO4, P2O5, HPO3; В) Ca3P2, PH3, NaPO3
А
7. Какое из утверждений неверно: «Атом фосфора по сравнению с атомом азота
имеет»:
А) больший радиус; Б) больший заряд ядра;
В) более ярко выраженные неметаллические свойства.
В
Слайд 31Шерлок Холмс: «Фосфор! Странная смесь…Совершенно без запаха. Состав преступления теперь налицо…»
Слайд 33А. Е. Ферсман
Мечтая раздобыть свой философский камень,
Способный приоткрыть златые ворота,
Слайд 35РЕФЛЕКСИЯ
На уроке было комфортно
и все понятно
На уроке немного
затруднялся, не все
На уроке было трудно,
ничего не понял