Пархоменко Г.Ю.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Феррум (железо)
Содержание
- 1. Презентация по химии на тему Феррум (железо)
- 2. Слайд 2
- 3. Характеристика элемента2. 26 электронов, 26 протонов, 30
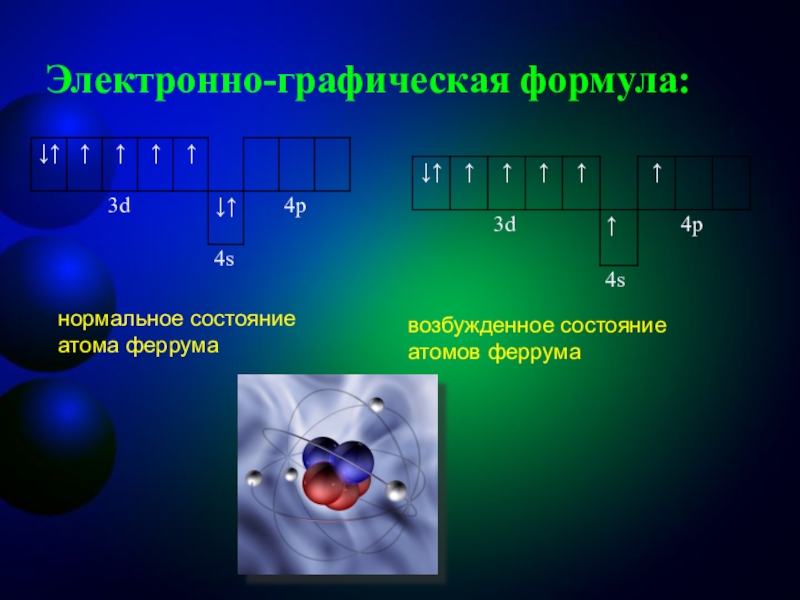
- 4. Электронно-графическая формула: нормальное состояние атома феррумавозбужденное состояние атомов феррума
- 5. Феррум - один из самых распространенных
- 6. Минералы железаFe3O4 магнитный железняк или магнетит Fe2O3
- 7. Сидерит — FeCO3
- 8. Марказит — FeS2 — содержит 46,6
- 9. Биологическая роль ФеррумаФеррум входит в состав гемоглобина,
- 10. Источники Феррума в питанииШпинатСалатКапустаЧерная черешняГовядинаТелятинаЯблоки
- 11. Железо как простое вещество Феррума
- 12. Простое вещество железо — ковкий металл серебристо-белого
- 13. Химические свойства железа
- 14. Железо — активный металл.На воздухе образуется защитная
- 15. Получение1. Чистое железо можно получить электролитическим восстановлением
- 16. Роль железа в истории цивилизацииЖелезо сыграло большую
- 17. Роль железа в истории цивилизацииВ настоящее время
- 18. Источники информацииhttp://ru.wikipedia.org/wiki/http://ru.wikipedia.org/wiki/Железоhttp://chem100.ru/elem.php?n=26http://biotaupe.org/him-sv-va.htm
Характеристика элемента2. 26 электронов, 26 протонов, 30 нейтронов относительная атомная масса 56.3. 4 электронных слоя, 2)8)14)2), электронная конфигурация 1s22s22p63s23p63d64s24. Степень окисления 0,+2, +3 и иногда + 6; является восстановителем.1. В периодической системе
Слайд 1Феррум и его соединения
Компьютерная презентация
по химии
Пархоменко Артёма,
учащегося 10-а класса УВК МТЛ
Учитель:
Слайд 3Характеристика элемента
2. 26 электронов, 26 протонов, 30 нейтронов относительная атомная масса
56.
3. 4 электронных слоя, 2)8)14)2), электронная конфигурация 1s22s22p63s23p63d64s2
4. Степень окисления 0,+2, +3 и иногда + 6; является восстановителем.
1. В периодической системе железо находится в четвертом периоде, в побочной подгруппе VIII группы, порядковый номер 26.
Слайд 4Электронно-графическая формула:
нормальное состояние атома феррума
возбужденное состояние атомов феррума
Слайд 5 Феррум - один из самых распространенных в природе элементов. В
земной коре его массовая доля составляет 5,10%, и оно уступает лишь Оксигену, Силицию и Алюминию. Много железа содержится и в небесных телах, что установлено методом спектрального анализа. Феррум входит в состав большинства горных пород. Для получения железа используют железные руды с содержанием Феррума 30-70%.
Распространение в природе
Слайд 6Минералы железа
Fe3O4 магнитный железняк или магнетит
Fe2O3 красный железняк или
гематит
2Fe2O3.3H2O бурый железняк или лимонит
FeS2 железный или серный колчедан
FeSO4.7H2O железный купорос
2Fe2O3.3H2O бурый железняк или лимонит
FeS2 железный или серный колчедан
FeSO4.7H2O железный купорос
Слайд 7 Сидерит — FeCO3 содержит примерно 35 %
железа. Обладает желтовато-белым (с серым или коричневым оттенком в случае загрязнения) цветом.
Слайд 8 Марказит — FeS2 — содержит 46,6 % железа. Встречается в
виде жёлтых, как латунь, бипирамидальных ромбических кристаллов
Слайд 9Биологическая роль Феррума
Феррум входит в состав гемоглобина, миоглобина, различных ферментов и
других сложных железобелковых комплексов, которые находятся в печени и селезенке. Феррум стимулирует функцию кроветворных органов.
Слайд 12Простое вещество железо — ковкий металл серебристо-белого цвета с температурой плавления
15390С, обладает парамагнитными свойствами, хорошей тепло- и электропроводностью, с высокой химической реакционной способностью
Физические свойства железа
Слайд 14Железо — активный металл.
На воздухе образуется защитная оксидная пленка, препятствующая коррозии
металла.
3Fe + 2O2 = Fe2O3 • FeO (Феррит железа)
2. Во влажном воздухе железо окисляется и покрывается ржавчиной, которая частично состоит из гидратированного феррум(III) оксида.
4Fe + 3О2 + 6Н2О = 4Fe(ОН)3
3. Взаимодействует с хлором, углеродом и другими неметаллами при нагревании:
2Fe + 3Cl2 = 2FeCl3
4.Железо вытесняет из растворов солей металлы, находящиеся в электрохимическом ряду напряжений правее железа:
Fe + CuSO4 = FeSO4 + Cu
5. Растворяется в разбавленных сульфатной и хлоридной кислотах c выделением водорода:
Fe + 2HCl = FeCl2 + H2
3Fe + 2O2 = Fe2O3 • FeO (Феррит железа)
2. Во влажном воздухе железо окисляется и покрывается ржавчиной, которая частично состоит из гидратированного феррум(III) оксида.
4Fe + 3О2 + 6Н2О = 4Fe(ОН)3
3. Взаимодействует с хлором, углеродом и другими неметаллами при нагревании:
2Fe + 3Cl2 = 2FeCl3
4.Железо вытесняет из растворов солей металлы, находящиеся в электрохимическом ряду напряжений правее железа:
Fe + CuSO4 = FeSO4 + Cu
5. Растворяется в разбавленных сульфатной и хлоридной кислотах c выделением водорода:
Fe + 2HCl = FeCl2 + H2
Слайд 15Получение
1. Чистое железо можно получить электролитическим восстановлением солей железа.
FeCl2 = Fe2+
+ 2Cl-
2. Восстановление оксидов железа Fe2O3 и Fe3O4 при алюминотермии:
8Al + 3Fe3O4 = 9Fe + 4Al2O3
3. Основная масса железа используется не в чистом виде, а виде сплавов с углеродом (чугуна и стали) и другими элементами. Основная масса железа вырабатывается в доменных печах. Процесс, протекающий в доменной печи при получении сплавов железа, основан на восстановлении оксидов железа при нагревании:
3Fe2O3 + CO = 2Fe3O4 + CO2
Fe3O4 + CO = 3FeO + CO2
FeO + CO = Fe + CO2
FeO + C = Fe + CO
2. Восстановление оксидов железа Fe2O3 и Fe3O4 при алюминотермии:
8Al + 3Fe3O4 = 9Fe + 4Al2O3
3. Основная масса железа используется не в чистом виде, а виде сплавов с углеродом (чугуна и стали) и другими элементами. Основная масса железа вырабатывается в доменных печах. Процесс, протекающий в доменной печи при получении сплавов железа, основан на восстановлении оксидов железа при нагревании:
3Fe2O3 + CO = 2Fe3O4 + CO2
Fe3O4 + CO = 3FeO + CO2
FeO + CO = Fe + CO2
FeO + C = Fe + CO
Слайд 16Роль железа в истории цивилизации
Железо сыграло большую роль в развитии человеческого
общества и не потеряло своего значения и в настоящее время: из всех металлов оно наиболее широко используется в современной промышленности.
Первобытный человек стал использовать железные орудия за несколько тысячелетий до нашей эры. Тогда единственным источником этого металла были упавшие на Землю метеориты, которые содержат довольно чистое железо. Это породило у многих народов легенды, дошедшие до наших дней, о небесном происхождении железа.
В середине II тысячелетия до н.э. в Египте была освоена металлургия железа - получение его из железных руд. Это положило начало железному веку в истории человечества, который пришел на смену каменному и бронзовому векам. На территории нашей страны начало железного века относят к рубежу II и I тысячелетий до н. э.
Первобытный человек стал использовать железные орудия за несколько тысячелетий до нашей эры. Тогда единственным источником этого металла были упавшие на Землю метеориты, которые содержат довольно чистое железо. Это породило у многих народов легенды, дошедшие до наших дней, о небесном происхождении железа.
В середине II тысячелетия до н.э. в Египте была освоена металлургия железа - получение его из железных руд. Это положило начало железному веку в истории человечества, который пришел на смену каменному и бронзовому векам. На территории нашей страны начало железного века относят к рубежу II и I тысячелетий до н. э.
Слайд 17Роль железа в истории цивилизации
В настоящее время основным промышленным способом переработки
железных руд является производство чугуна доменным процессом. Чугун - это сплав железа, содержащий 2,2-4% углерода, кремний, марганец, фосфор, серу. В дальнейшем большая часть чугуна подвергается переделу на сталь. Сталь отличается от чугуна главным образом меньшим содержанием углерода (до 2%), фосфора и серы.
В последнее время большое внимание уделяется разработке методов прямого получения железа из руд без осуществления доменного процесса. Еще в 1899 г. Д. И. Менделеев писал: "Я полагаю, что придет со временем опять пора искать способов прямого получения железа и стали из руд, минуя чугун". Слова великого химика оказались пророческими: такие способы найедены и реализованы в промышленности.
В последнее время большое внимание уделяется разработке методов прямого получения железа из руд без осуществления доменного процесса. Еще в 1899 г. Д. И. Менделеев писал: "Я полагаю, что придет со временем опять пора искать способов прямого получения железа и стали из руд, минуя чугун". Слова великого химика оказались пророческими: такие способы найедены и реализованы в промышленности.