Н2О
Д) К2О
2. Как называется положительно заряженные ионы?
А) катионы Б) молекулы
В) анионы Г) кристаллы
3. Каком ряду располагаются вещества ионного соединения?
А) СН4, NН3, Мg
Б) СI2, МgО, NаСI
В) МgF2, NаСI, СаСI2
Г) Н2S, НСI, Н2О
4. Валентность определяются по:
А) по номеру группы
Б) по числу неспаренных электронов
В) по типу химической связи
Г) по номеру периода.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Электроотрицательность. Степень окисления
Содержание
- 1. Презентация по химии на тему Электроотрицательность. Степень окисления
- 2. Слайд 2
- 3. Продолжить изучение валентности. Дать понятие степени окисления.
- 4. Развивающие: -научить приемам сравнения и обобщения изучаемых
- 5. В соединениях с ионной связью степени окисления элементов равна зарядам ионов
- 6. В соединениях с ковалентной неполярной связью (в
- 7. Степень окисления элемента – это условный заряд
- 8. Степень окисления атома в отличие от валентности
- 9. Валентность обозначатся римскими цифрами сверху символа элемента:
- 10. Положительная степень окисления –равна числу электронов, отданных
- 11. Отрицательная степень окисления равна числу электронов, принятых
- 12. У элементов главных подгрупп IV-VII групп минимальная
- 13. Значение степени окисления между высшим
- 14. Для определения степени окисления атома в соединении
- 15. Алгоритм составления формулы в соединениях:
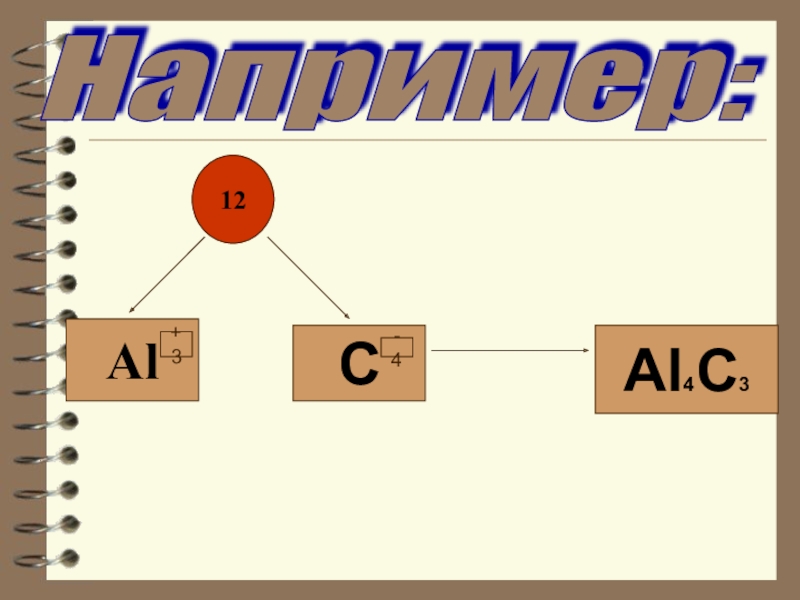
- 16. ЗАДАНИЕ: Найти с.о. элементов
- 17. Например: 12AlCAl4C3-4+3
- 18. Если степень окисления четное – нечетное,
- 19. Если степень окисления имеет четное значение, то
- 20. 2 способ 1) Обозначим степень окисления
- 21. 4) Составить алгебраическое уравнение:2Х+
- 22. Домашнее задание конспект
«Степень окисления. Определение степени окисления в соединениях»Тема:
Слайд 3Продолжить изучение валентности.
Дать понятие степени окисления.
Рассмотреть виды степеней окисления:
положительная, отрицательная, нулевое значение.
Научиться правильно определять степени окисления атома в соединении.
Научиться правильно определять степени окисления атома в соединении.
Цели урока
Слайд 4Развивающие:
-научить приемам сравнения и обобщения изучаемых понятий;
- отработать умения и
навыки в определении степени окисления по химическим формулам;
- продолжить развитие навыков самостоятельной работы;
-способствовать развитию логического мышления.
Воспитальные:
- формировать чувство толерантности (терпимости и уважения к чужому мнению) взаимопомощи;
- осуществлять эстетическое воспитание (через оформление доски и тетрадей, при применении презентаций).
- продолжить развитие навыков самостоятельной работы;
-способствовать развитию логического мышления.
Воспитальные:
- формировать чувство толерантности (терпимости и уважения к чужому мнению) взаимопомощи;
- осуществлять эстетическое воспитание (через оформление доски и тетрадей, при применении презентаций).
Задачи урока
Слайд 6В соединениях с ковалентной неполярной связью (в молекулах простых веществ) степень
окисления элементов равна 0
Н2°, СI 2°, F2°, S °, AI °
Слайд 7
Степень окисления элемента – это условный заряд его атома, в молекуле,
если считать, что молекула состоит из ионов
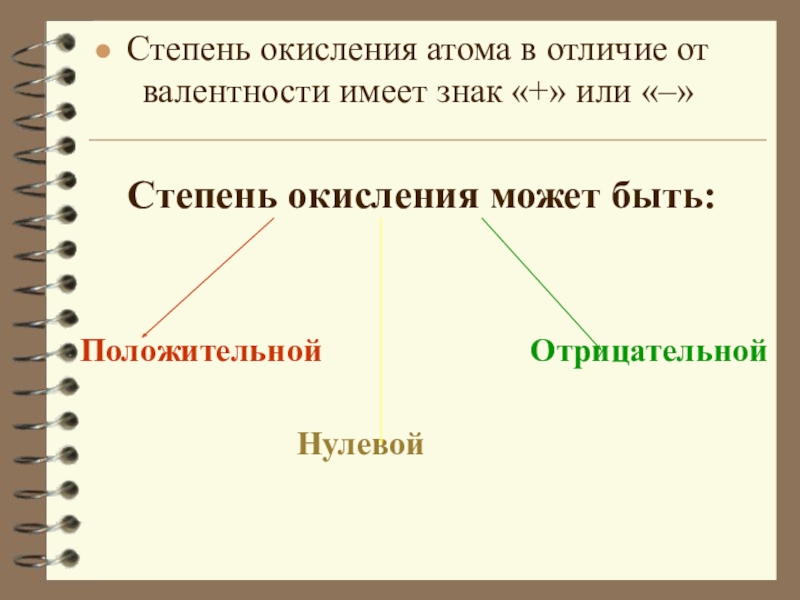
Слайд 8Степень окисления атома в отличие от валентности имеет знак «+» или
«–»
Степень окисления может быть:
Положительной Отрицательной
Нулевой
Степень окисления может быть:
Положительной Отрицательной
Нулевой
Слайд 9Валентность обозначатся римскими цифрами сверху символа элемента:
II I IV
Fe Cu S
а степень окисления обозначается арабскими цифрами с зарядом над символам элемента
Мg+², Са +², Nа +¹, CIˉ¹
Fe Cu S
а степень окисления обозначается арабскими цифрами с зарядом над символам элемента
Мg+², Са +², Nа +¹, CIˉ¹
Слайд 10Положительная степень окисления –равна числу электронов, отданных данным атомам. Атом может
отдать все валентные электроны ( для главных групп это электроны внешнего уровня) соответствующее номеру группы, в котором находится элемент, проявляя при этом высшую степень окисления. (исключение О, F).
Например: высшая степень окисления главной
подгруппы II группы равна +2.
Zn +²
Положительную степень проявляют как металлы и неметаллы, кроме F, He, Ne.
C+ ¹, Nа +¹, AI +³,
Положительную степень проявляют только в соединении.
Например: высшая степень окисления главной
подгруппы II группы равна +2.
Zn +²
Положительную степень проявляют как металлы и неметаллы, кроме F, He, Ne.
C+ ¹, Nа +¹, AI +³,
Положительную степень проявляют только в соединении.
Слайд 11
Отрицательная степень окисления равна числу электронов, принятых данным атомом, ее проявляют
только неметаллы.
Атомы неметаллов присоединяют столько электронов, сколько их не хватает до завершения внешнего уровня, проявляя при этом отрицательную степень.
Атомы неметаллов присоединяют столько электронов, сколько их не хватает до завершения внешнего уровня, проявляя при этом отрицательную степень.
Слайд 12У элементов главных подгрупп IV-VII групп минимальная степень окисления численно
равна
Номер группы - 8 =
« минимальная отрицательная степень окисления»
Например:
S со степенью +6 высшая 6-8= - 2 S со степенью -2 низшая
N со степенью+5 высшая 5-8= - 3 N со степенью -3 низшая
Номер группы - 8 =
« минимальная отрицательная степень окисления»
Например:
S со степенью +6 высшая 6-8= - 2 S со степенью -2 низшая
N со степенью+5 высшая 5-8= - 3 N со степенью -3 низшая
Слайд 13 Значение степени окисления между высшим и низшим степенями окислений
называется промежуточным.
Например:
S+6 высшая низшая S-2
А промежуточными являются :
S – «0», S- «+2», S- «+4»
Например:
S+6 высшая низшая S-2
А промежуточными являются :
S – «0», S- «+2», S- «+4»
Слайд 14Для определения степени окисления атома в соединении следует учитывать ряд положений:
Степень
окисления F во всех соединениях равна « -1».
HF-1 NaF-1 CuF2-1
Степень окисления кислорода в большинстве соединений равна (-2) исключение
ОF2 , где степень окисления О+2, а у F-1
Водород в большинстве соединений имеет степень окисления +1, кроме соединения с активными металлами, где степень окисления (-1)
Например: NaH, где степень окисления Na +1, а у H-1
Степень окисления металлов главных подгрупп I, II, III групп во всех соединениях равна +1,+2,+3.
Элементы с постоянной степени окисления это:
А) щелочные металлы (Li, Na, K, Pb, Si, Fr) - степень окисления +1
Б) элементы II группы кроме (Hg): Be, Mg, Ca, Sr, Ra, Zn,Cd - степень окисления +2
В)элемент III группы: Al - степень окисления +3
Г) F (-1)
HF-1 NaF-1 CuF2-1
Степень окисления кислорода в большинстве соединений равна (-2) исключение
ОF2 , где степень окисления О+2, а у F-1
Водород в большинстве соединений имеет степень окисления +1, кроме соединения с активными металлами, где степень окисления (-1)
Например: NaH, где степень окисления Na +1, а у H-1
Степень окисления металлов главных подгрупп I, II, III групп во всех соединениях равна +1,+2,+3.
Элементы с постоянной степени окисления это:
А) щелочные металлы (Li, Na, K, Pb, Si, Fr) - степень окисления +1
Б) элементы II группы кроме (Hg): Be, Mg, Ca, Sr, Ra, Zn,Cd - степень окисления +2
В)элемент III группы: Al - степень окисления +3
Г) F (-1)
Слайд 15Алгоритм составления формулы в соединениях:
1 способ
На
первом месте пишется элемент с меньшей электроотрицательностью, на втором с большей электроотрицательностью.
Элемент написанное на первом месте имеет положительный заряд «+», а на втором с отрицательным зарядом «-».
Указать для каждого элемента степень окисления.
Найти общее кратное значение степеней окисления .
Разделить наименьшее общее кратное на значение степеней окисления и полученные индексы приписать внизу справа после символа соответствующего элемента.
Элемент написанное на первом месте имеет положительный заряд «+», а на втором с отрицательным зарядом «-».
Указать для каждого элемента степень окисления.
Найти общее кратное значение степеней окисления .
Разделить наименьшее общее кратное на значение степеней окисления и полученные индексы приписать внизу справа после символа соответствующего элемента.
Слайд 16 ЗАДАНИЕ: Найти с.о. элементов в соединениях: NO, SnO2, CuCl2, CuCl, BaH2, MgF2,
Al2S3
Составить формулы:
оксидов азота (III), (V);
нитридов: калия, кальция, бора; хлоридов: марганца (II), (IV), углерода(IV) фосфора (III), (V).
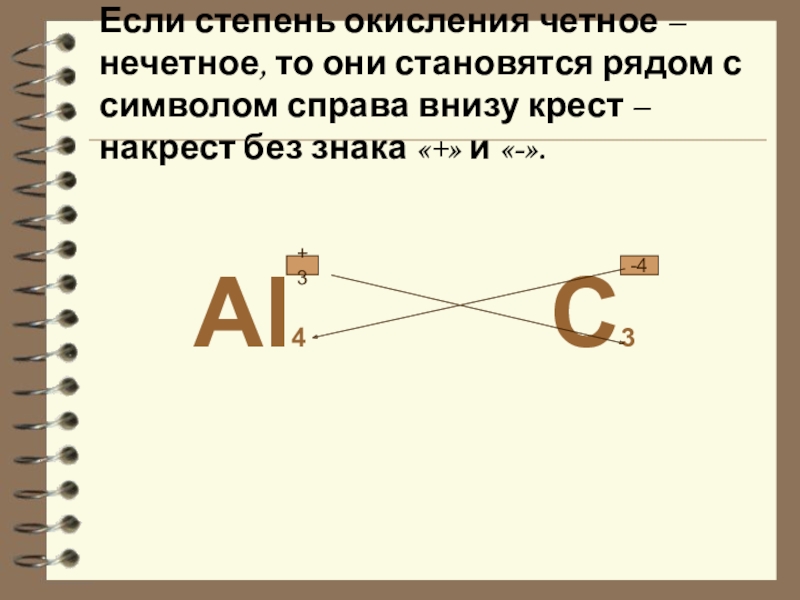
Слайд 18 Если степень окисления четное – нечетное, то они становятся рядом с
символом справа внизу крест – накрест без знака «+» и «-».
Al4 C3
+3
-4
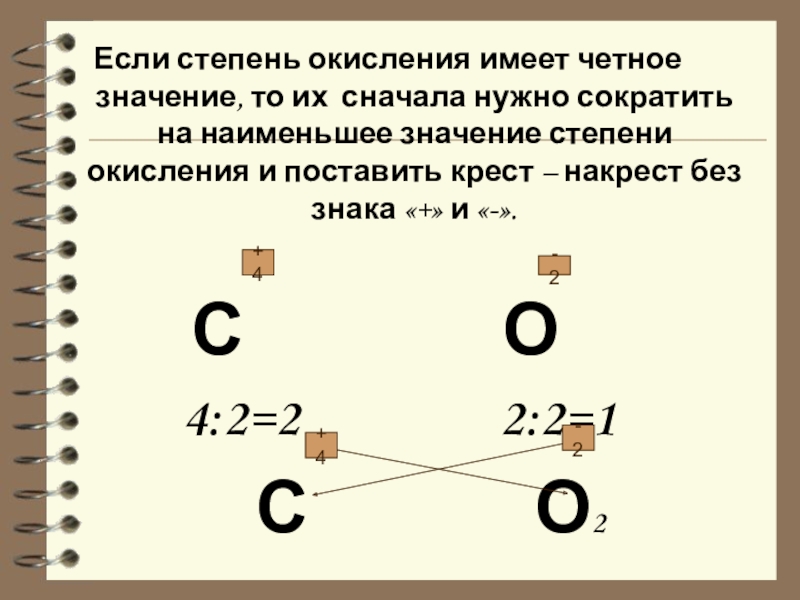
Слайд 19Если степень окисления имеет четное значение, то их сначала нужно сократить
на наименьшее значение степени окисления и поставить крест – накрест без знака «+» и «-».
С О
4:2=2 2:2=1
С О2
С О
4:2=2 2:2=1
С О2
+4
-2
+4
-2
Слайд 20 2 способ
1) Обозначим степень окисления N через Х, указать
степень окисления О
N2 О3
2) Определить сумму отрицательных зарядов, для этого степень окисления кислорода умножаем на индекс кислорода:
3· (-2)= -6
3) Чтобы молекула была электронейтральной нужно определить сумму положительных зарядов:
Х·2=2
N2 О3
2) Определить сумму отрицательных зарядов, для этого степень окисления кислорода умножаем на индекс кислорода:
3· (-2)= -6
3) Чтобы молекула была электронейтральной нужно определить сумму положительных зарядов:
Х·2=2
Х
-2