химии Пономарева С.А.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Электролитическая диссоциация. Сильные и слабые электролиты
Содержание
- 1. Презентация по химии Электролитическая диссоциация. Сильные и слабые электролиты
- 2. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ - ЭТО ПРОЦЕСС РАСПАДА
- 3. ЭЛЕКТРОЛИТЫЭлектролиты при растворении в воде или расплавлении распадаются (диссоциируют) на ионы – положительно (катионы) иотрицательно (анионы) заряженные частицы. В растворах и расплавах электролиты проводят электрический ток.
- 4. Слайд 4
- 5. Слайд 5
- 6. ДИССОЦИАЦИЯ КИСЛОТКислотами называются электролиты, при диссоциации которых в
- 7. ДИССОЦИАЦИЯ ОСНОВАНИЙ (ЩЕЛОЧЕЙ) Основаниями называются электролиты, при диссоциации
- 8. ДИССОЦИАЦИЯ СОЛЕЙ Солями называются электролиты, при диссоциации которых образуются
- 9. СТЕПЕНЬ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИСванте Аррениус для количественной характеристики
- 10. Слайд 10
- 11. По степени диссоциации электролиты делят на: сильные слабые.
- 12. ЭЛЕКТРОЛИТЫα>30%1. Растворимые соли;2. Сильные кислоты (НСl, HBr, HI, НNО3, НClO4, Н2SO4(разб.));3. Сильные основания – щёлочи.α
- 13. Слайд 13
- 14. ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЕОРИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ. Все вещества
- 15. ИСПОЛЬЗУЕМЫЕ РЕСУРСЫ: NSPORTAL.RU MYSHARED.RU
- 16. СПАСИБО ЗА ВНИМАНИЕ.
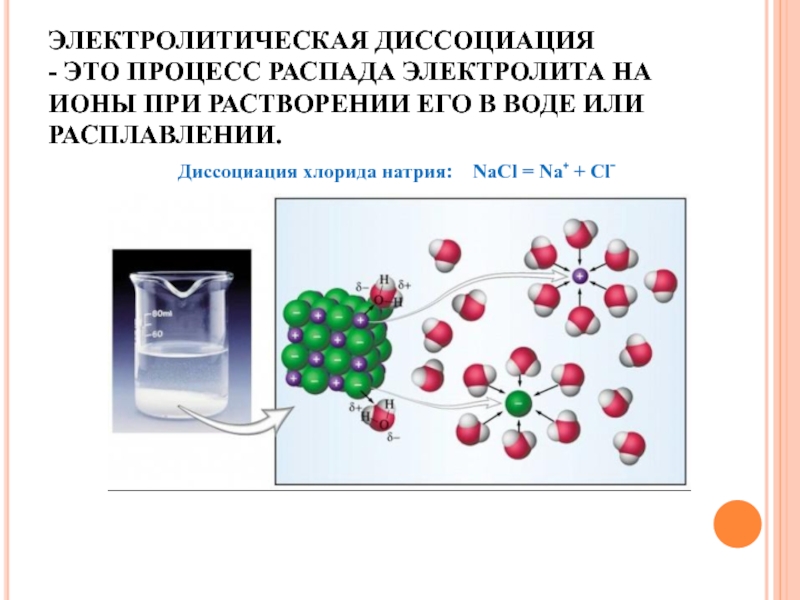
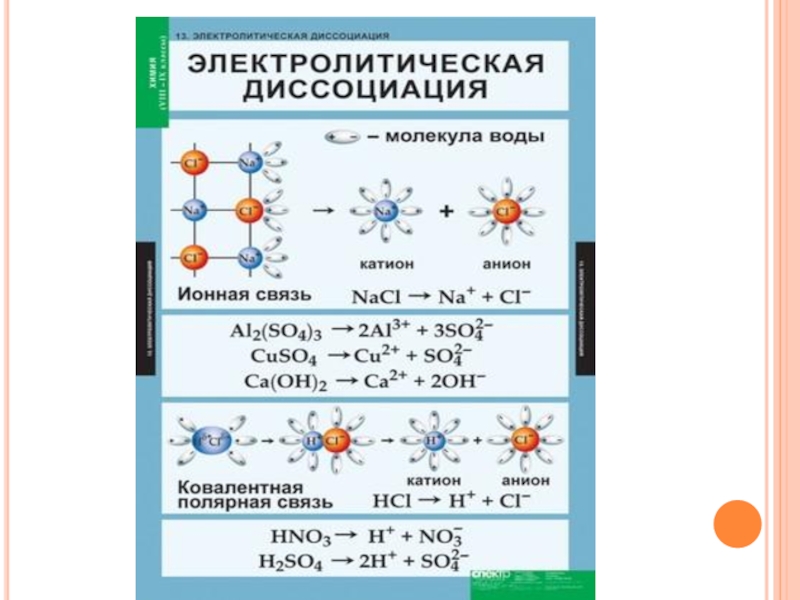
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ - ЭТО ПРОЦЕСС РАСПАДА ЭЛЕКТРОЛИТА НА ИОНЫ ПРИ РАСТВОРЕНИИ ЕГО В ВОДЕ ИЛИ РАСПЛАВЛЕНИИ.Диссоциация хлорида натрия: NaCl = Na⁺ + Cl⁻
Слайд 1ПРЕЗЕНТАЦИЯ НА ТЕМУ:
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ.
СИЛЬНЫЕ И СЛАБЫЕ ЭЛЕКТРОЛИТЫ.
составил Миронов И.Б.
11а класс
Учитель
Слайд 2ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ - ЭТО ПРОЦЕСС РАСПАДА ЭЛЕКТРОЛИТА НА ИОНЫ ПРИ РАСТВОРЕНИИ ЕГО
В ВОДЕ ИЛИ РАСПЛАВЛЕНИИ.
Диссоциация хлорида натрия: NaCl = Na⁺ + Cl⁻
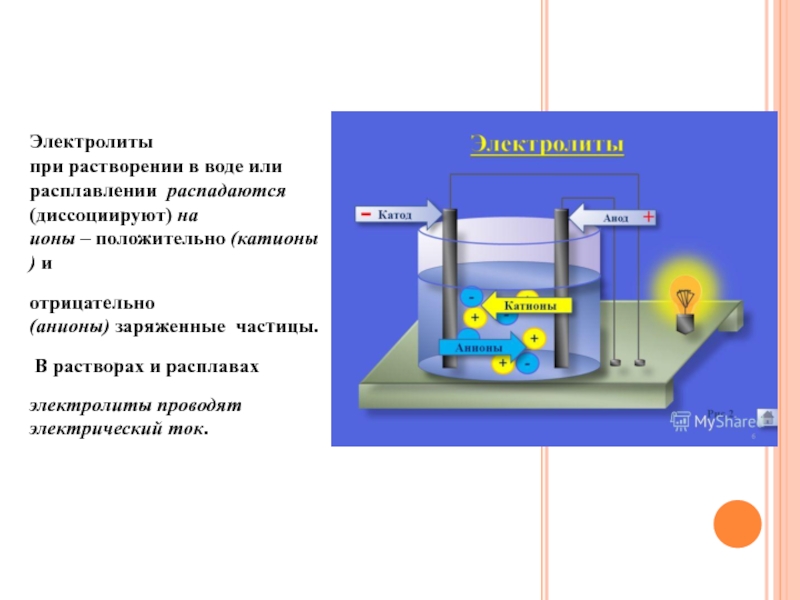
Слайд 3ЭЛЕКТРОЛИТЫ
Электролиты при растворении в воде или расплавлении распадаются (диссоциируют) на ионы – положительно (катионы) и
отрицательно (анионы) заряженные частицы.
В растворах и расплавах
электролиты
проводят электрический ток.
Слайд 6ДИССОЦИАЦИЯ КИСЛОТ
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только
катионы водорода (H +).
Например,
HCl -> H + + Cl -
HNO 3 -> H + + NO 3 -
Многоосновные кислоты диссоциируют ступенчато :
Н3РО4 ↔ Н+ + Н2РО₄- (первая ступень) – дигидрофосфат- ион
Н2РО-4 ↔ Н+ + НРO₄2- (вторая ступень) – гидрофосфат- ион
НРО2-4 ↔ Н+ + PОЗ-4 (третья ступень) – ортофосфат -ион
Например,
HCl -> H + + Cl -
HNO 3 -> H + + NO 3 -
Многоосновные кислоты диссоциируют ступенчато :
Н3РО4 ↔ Н+ + Н2РО₄- (первая ступень) – дигидрофосфат- ион
Н2РО-4 ↔ Н+ + НРO₄2- (вторая ступень) – гидрофосфат- ион
НРО2-4 ↔ Н+ + PОЗ-4 (третья ступень) – ортофосфат -ион
Слайд 7ДИССОЦИАЦИЯ ОСНОВАНИЙ (ЩЕЛОЧЕЙ)
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются
только гидроксид-ионы (OH -).
KOH -> K + + OH -;
NH 4OH ↔ NH +4 + OH -
Многокислотные основания диссоциируют ступенчато:
Ba(ОН)2 -> Bа(ОН)+ + OH-(первая ступень)
Ba(OH)+ ↔ Ba2++ OH- (вторая ступень)
KOH -> K + + OH -;
NH 4OH ↔ NH +4 + OH -
Многокислотные основания диссоциируют ступенчато:
Ba(ОН)2 -> Bа(ОН)+ + OH-(первая ступень)
Ba(OH)+ ↔ Ba2++ OH- (вторая ступень)
Слайд 8ДИССОЦИАЦИЯ СОЛЕЙ
Солями называются электролиты, при диссоциации которых образуются катионы металлов, а также катион
аммония (NH+4) и анионы кислотных остатков.
Например, диссоциация средних солей :
(NH4)2SO4 -> 2NH₄++ SO₄2-;
Na3PO 4 -> 3 Na + + PO₄3-
Например, диссоциация средних солей :
(NH4)2SO4 -> 2NH₄++ SO₄2-;
Na3PO 4 -> 3 Na + + PO₄3-
Слайд 9СТЕПЕНЬ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
Сванте Аррениус для количественной характеристики электролитической диссоциации ввел понятие
степень электролитической диссоциации. Поскольку электролитическая диссоциация - процесс обратимый, то в растворах электролитов наряду с их ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации (обозначается греческой буквой альфа α). Степень электролитической диссоциации – это отношение числа молекул вещества, распавшегося на ионы, к общему количеству растворенного вещества. α=n/N, где n-число молекул, распавшихся на ионы; N- общее число растворенных молекул
Слайд 12ЭЛЕКТРОЛИТЫ
α>30%
1. Растворимые соли;
2. Сильные кислоты
(НСl, HBr, HI, НNО3, НClO4, Н2SO4(разб.));
3.
Сильные основания – щёлочи.
α<3%
1. Почти все органические кислоты (CH3COOH- уксусная и др.);
2. Некоторые неорганические кислоты (H2CO3, H2S и др.);
3. Почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca3(PO4)2; Cu(OH)2; Al(OH)3; NH4OH);
4. Вода.
сильные
слабые
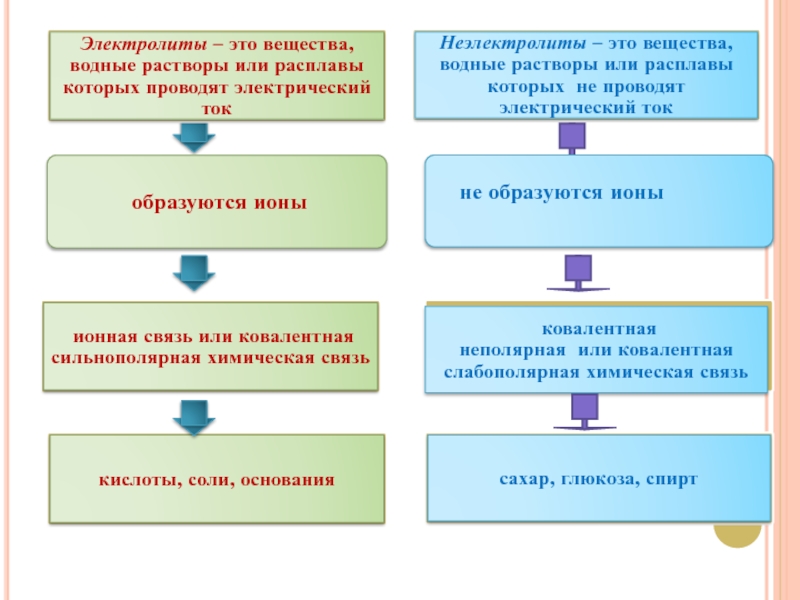
Слайд 14ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЕОРИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ.
Все вещества можно разделить на электролиты
и неэлектролиты.
Электролиты в растворах и расплавах распадаются на ионы.
Распад электролита на ионы зависит от степени электролитической диссоциации - α
Электролиты в растворах и расплавах распадаются на ионы.
Распад электролита на ионы зависит от степени электролитической диссоциации - α