- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Электронная природа химических связей (10 класс)
Содержание
- 1. Презентация по химии на тему Электронная природа химических связей (10 класс)
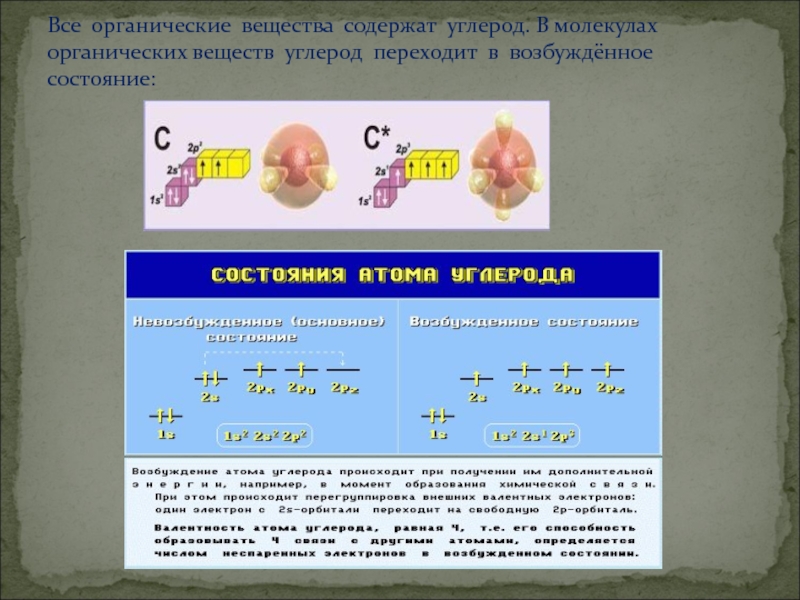
- 2. Все органические вещества содержат углерод. В молекулах органических веществ углерод переходит в возбуждённое состояние:
- 3. Ковалентная связь в молекулах характеризуется: энергией, длиной, насыщаемостью и пространственной направленностью.Органическим соединениям свойственны ковалентные связи.
- 4. Ковалентная связь образуется за счёт перекрывания электронных
- 5. Длина связи определяется расстоянием между центрами ядер
- 6. Под насыщаемостью связи понимают способность образовывать строго определённое количество ковалентных связей.
- 7. Направленность ковалентной связи определяется взаимным расположением электронных
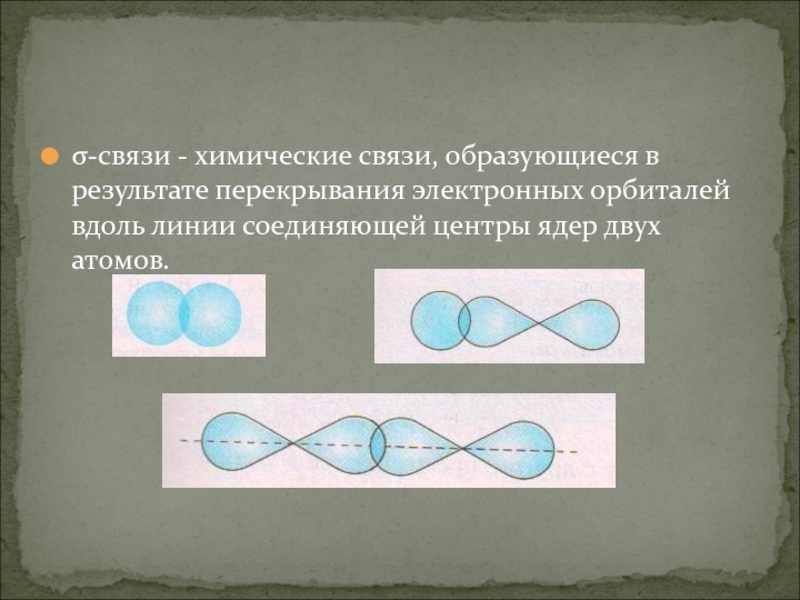
- 8. σ-связи - химические связи, образующиеся в результате
- 9. π-связи - химические связи, образующиеся в результате
- 10. Слайд 10
- 11. Разрыв связи, при котором каждый атом получает
- 12. Если при разрыве связи общая электронная пара
- 13. Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. Органическая химия 10 класс» М.: «Просвещение», 2012 г.https://sites.google.com/site/himulacom/zvonok-na-urok/10-klass---tretij-god-obuceniaЛитература
Все органические вещества содержат углерод. В молекулах органических веществ углерод переходит в возбуждённое состояние:
Слайд 1Электронная природа химических связей в органических соединениях. Способы разрыва связей в молекулах органических веществ.
Слайд 2Все органические вещества содержат углерод. В молекулах органических веществ углерод переходит
в возбуждённое состояние:
Слайд 3Ковалентная связь в молекулах характеризуется: энергией, длиной, насыщаемостью и пространственной направленностью.
Органическим
соединениям свойственны ковалентные связи.
Слайд 4Ковалентная связь образуется за счёт перекрывания электронных облаков, при этом выделяется
энергия, чем больше перекрывание, тем больше выделяется энергии и тем прочнее связь.
Типы перекрываний электронных облаков в порядке возрастания их прочности и энергии выделяемой при образовании:
σ(s – s) < σ(s – p) < σ (p – p)
Типы перекрываний электронных облаков в порядке возрастания их прочности и энергии выделяемой при образовании:
σ(s – s) < σ(s – p) < σ (p – p)
Слайд 5Длина связи определяется расстоянием между центрами ядер связывающихся атомов и измеряется
в нанометрах (1 нм = 10-9 м). С повышением кратности связи (одинарная, двойная, тройная) длина становится меньше, а энергия выше:
(С – С) < (C = C) < (C ≡ C)
(С – С) < (C = C) < (C ≡ C)
Слайд 6Под насыщаемостью связи понимают способность образовывать строго определённое количество ковалентных связей.
Слайд 7Направленность ковалентной связи определяется взаимным расположением электронных облаков, участвующих в образовании
химической связи. Ковалентная связь образуется в направлении максимального перекрывания электронных орбиталей взаимодействующих атомов.
Слайд 8σ-связи - химические связи, образующиеся в результате перекрывания электронных орбиталей вдоль
линии соединяющей центры ядер двух атомов.
Слайд 9π-связи - химические связи, образующиеся в результате «бокового» перекрывания электронных орбиталей
вне линии связи, соединяющей центры ядер атомов.
Слайд 11Разрыв связи, при котором каждый атом получает по одному электрону из
общей пары, называется гомолитическим:
Например,
CH4 свет→ CH3∙ + ∙H
Cl2 свет→ Cl∙ + ∙Cl
В результате образуются сходные по электронному строению частицы, каждая из которых имеет неспаренный электрон. Такие частицы называются свободными радикалами.
Радикал – свободный атом или частица с неспаренными электронами, неустойчив и способный быстро вступать в химическую реакцию.
Гомолитическому разрыву подвергаются малополярные или неполярные связи C-C, C-H, Cl-Cl и др.
Например,
CH4 свет→ CH3∙ + ∙H
Cl2 свет→ Cl∙ + ∙Cl
В результате образуются сходные по электронному строению частицы, каждая из которых имеет неспаренный электрон. Такие частицы называются свободными радикалами.
Радикал – свободный атом или частица с неспаренными электронами, неустойчив и способный быстро вступать в химическую реакцию.
Гомолитическому разрыву подвергаются малополярные или неполярные связи C-C, C-H, Cl-Cl и др.
Слайд 12Если при разрыве связи общая электронная пара остается у одного атома,
то такой разрыв называется гетеролитическим:
А+ - электрофильная частица,
:В- - нуклеофильная частица
Например,
CH3Сl → CH3+ + :Cl-
В результате образуются разноименно заряженные ионы - катион и анион.
Ионный тип разрыва связи характерен для П- связей и полярных σ – связей
А+ - электрофильная частица,
:В- - нуклеофильная частица
Например,
CH3Сl → CH3+ + :Cl-
В результате образуются разноименно заряженные ионы - катион и анион.
Ионный тип разрыва связи характерен для П- связей и полярных σ – связей
Слайд 13Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. Органическая химия 10 класс» М.: «Просвещение»,
2012 г.
https://sites.google.com/site/himulacom/zvonok-na-urok/10-klass---tretij-god-obucenia
https://sites.google.com/site/himulacom/zvonok-na-urok/10-klass---tretij-god-obucenia
Литература