- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Электролиз 11 класс
Содержание
- 1. Презентация по химии на тему Электролиз 11 класс
- 2. ЭЛЕКТРОЛИЗ - это физико-химический процесс, состоящий
- 3. Электролиз является одним из лучших способов золочения
- 4. ПРИМЕНЕНИЕЭлектролиз широко применяется в современной промышленности. В частности,
- 5. Первый закон ФарадеяВ 1832 году Фарадей установил, что масса m вещества,
- 6. Второй закон ФарадеяЭлектрохимические эквиваленты различных веществ пропорциональны
- 7. КАТОДНа катоде ( К–)происходят процессы восстановления: положительные ионы
- 8. АНОДНа аноде (А+)могут окисляться анионы, нейтральные молекулы и
- 9. Мнемоническое правилоДля запоминания катодных и анодных процессов
- 10. Электролиз в газахЭлектролиз в газах, при наличии
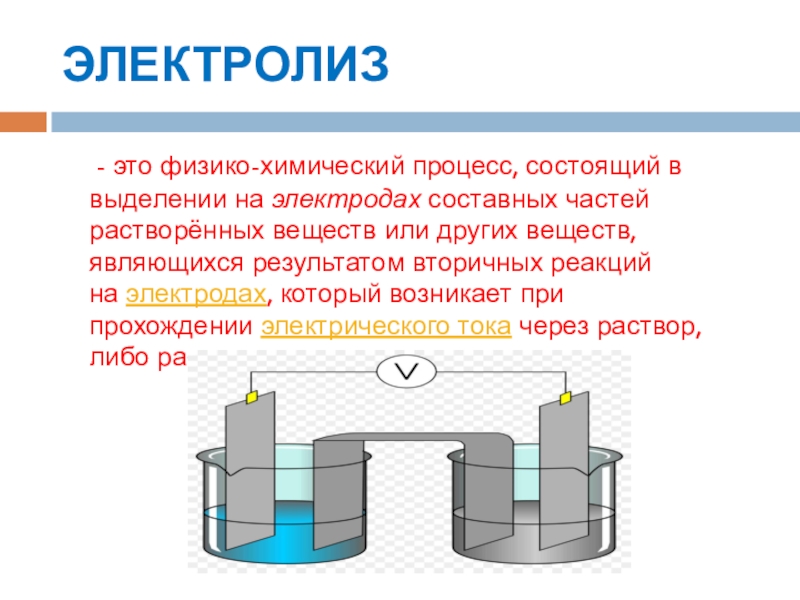
ЭЛЕКТРОЛИЗ - это физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав электролита.
Слайд 2ЭЛЕКТРОЛИЗ
- это физико-химический процесс, состоящий в выделении на электродах составных частей
растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав электролита.
Слайд 3Электролиз является одним из лучших способов золочения или покрытия металла медью,
золотом и т.д.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создаётся электродами — проводниками, соединёнными с полюсами источника электрической энергии. Катодом при электролизе называется отрицательный электрод, анодом — положительный. Положительные ионы — катионы (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Реакции, происходящие при электролизе на электродах, называются вторичными. Первичными являются реакции диссоциации в электролите. Разделение реакций на первичные и вторичные помогло Майклу Фарадею установить законы электролиза.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создаётся электродами — проводниками, соединёнными с полюсами источника электрической энергии. Катодом при электролизе называется отрицательный электрод, анодом — положительный. Положительные ионы — катионы (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Реакции, происходящие при электролизе на электродах, называются вторичными. Первичными являются реакции диссоциации в электролите. Разделение реакций на первичные и вторичные помогло Майклу Фарадею установить законы электролиза.
Слайд 4ПРИМЕНЕНИЕ
Электролиз широко применяется в современной промышленности. В частности, электролиз является одним из
способов промышленного получения алюминия , меди, водорода, диоксида марганца[2], пероксида водорода. Большое количество металлов извлекается из руд и подвергается переработке с помощью электролиза (электроэкстракция, электрорафинирование). Также электролиз является основным процессом, благодаря которому функционирует химический источник тока.
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации).
Применяется для получения многих веществ (металлов, водорода, хлора и др.), при нанесении металлических покрытий (гальваностегия), воспроизведении формы предметов (гальванопластика).
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации).
Применяется для получения многих веществ (металлов, водорода, хлора и др.), при нанесении металлических покрытий (гальваностегия), воспроизведении формы предметов (гальванопластика).
Слайд 5Первый закон Фарадея
В 1832 году Фарадей установил, что масса m вещества, выделившегося на электроде, прямо
пропорциональна электрическому заряду q, прошедшему через электролит:
m=k*q=k*l*t,если через электролит пропускается в течение времени t постоянный ток с силой тока I.
Коэффициент пропорциональности называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
m=k*q=k*l*t,если через электролит пропускается в течение времени t постоянный ток с силой тока I.
Коэффициент пропорциональности называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
Слайд 6Второй закон Фарадея
Электрохимические эквиваленты различных веществ пропорциональны их молярным массам и
обратно пропорциональны числам, выражающим их химическую валентность.
Слайд 7КАТОД
На катоде ( К–)происходят процессы восстановления: положительные ионы или нейтральные молекулы принимают
электроны и переходят в восстановленную форму.На катоде в первую очередь идут процессы, характеризующиеся более положительным потенциалом, т.е. восстанавливаются более сильные окислители.
Слайд 8АНОД
На аноде (А+)могут окисляться анионы, нейтральные молекулы и сам материал анода. Анод
может быть растворимым, т.е. окисляться в условиях электролиза, и инертным, нерастворимым, т.е. не участвовать в анодном процессе. К растворимым или частично растворимым анодам относятсяZn,Cu,Fe,Cd,Ag,Ni,Coи т.д., к нерастворимым –Pt,Pdи некоторые другие благородные металлы в определенных условиях, а также графит С. На аноде в первую очередь окисляются более сильные восстановители, т.е. идут процессы, характеризующиеся более отрицательным потенциалом.
Слайд 9Мнемоническое правило
Для запоминания катодных и анодных процессов в
электрохимии существует следующее
мнемоническое
правило:
У анода анионы окисляются.
На катоде катионы восстанавливаются.
В первой строке все слова начинаются с гласной буквы, во второй — с согласной.
Или проще:
КАТод — КАТионы (ионы у катода)
АНод — АНионы (ионы у анода)
правило:
У анода анионы окисляются.
На катоде катионы восстанавливаются.
В первой строке все слова начинаются с гласной буквы, во второй — с согласной.
Или проще:
КАТод — КАТионы (ионы у катода)
АНод — АНионы (ионы у анода)
Слайд 10Электролиз в газах
Электролиз в газах, при наличии ионизатора, объясняется
тем, что
при прохождении через них постоянного
электрического тока наблюдается выделение веществ на
электродах. Законы Фарадея в газах не действительны, но
существуют несколько закономерностей:
при отсутствии ионизатора электролиз проводиться не будет, даже при высоком напряжении;
электролизу подвергаются только бескислородные кислоты в газообразном состоянии и некоторые газы;
уравнения электролиза, как в электролитах, так и в газах, всегда остаются постоянными.
электрического тока наблюдается выделение веществ на
электродах. Законы Фарадея в газах не действительны, но
существуют несколько закономерностей:
при отсутствии ионизатора электролиз проводиться не будет, даже при высоком напряжении;
электролизу подвергаются только бескислородные кислоты в газообразном состоянии и некоторые газы;
уравнения электролиза, как в электролитах, так и в газах, всегда остаются постоянными.


![Презентация по химии на тему Электролиз 11 класс ПРИМЕНЕНИЕЭлектролиз широко применяется в современной промышленности. В частности, электролиз является одним из ПРИМЕНЕНИЕЭлектролиз широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения алюминия , меди, водорода, диоксида марганца[2], пероксида](/img/thumbs/34667dfdc3f8a2708ad5bb6d31fc5b45-800x.jpg)











