- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Электролитическая диссоциация (9 класс)
Содержание
- 1. Презентация по химии на тему: Электролитическая диссоциация (9 класс)
- 2. Фарадей Майкл22. IX.1791 – 25.VIII. 1867В первой
- 3. Слайд 3
- 4. Неэлектролиты
- 5. Сванте Август Аррениус-
- 6. Русские химики И.А.Каблуков и В.А.Кистяковский применили к
- 7. Механизм ЭД ионных веществ Ориентация диполей
- 8. + -Механизм диссоциации электролитов с ионной
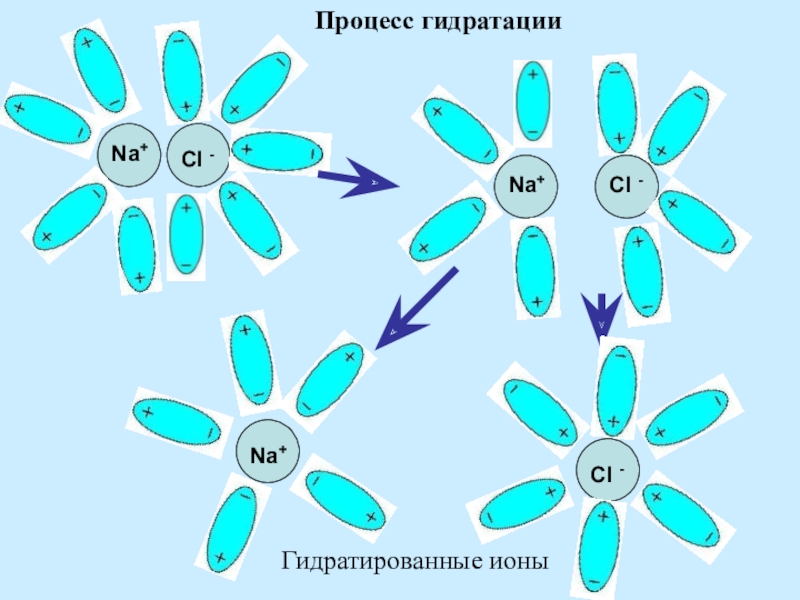
- 9. Na+Cl -Na+Cl -Na+Cl -Гидратированные ионыПроцесс гидратации
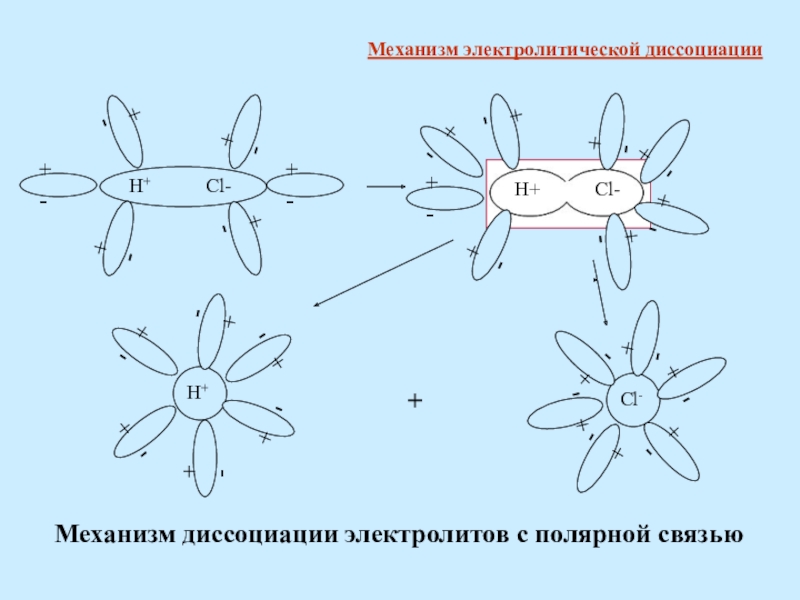
- 10. + -Механизм диссоциации электролитов с полярной связьюМеханизм электролитической диссоциации
- 11. Электролитическая диссоциация веществ, идущая с образованием свободных
- 12. K2CO3 ↔ 2K+ + CO32-Дописать пример:
- 13. Кислоты, основания и соли с точки
- 14. Уравнение диссоциации сильных оснований (щелочей)Ba(OH)2 ↔ Ba2+
- 15. Домашнее задание: п.1-2 (учебник) р\т стр.8 Н.И.Габрусёва
- 16. Выберите смайлик, который выражает ваше настроение (грустное, весёлое, без эмоций) 123
- 17. Использованные ресурсы:http://pedsovet.su/load/171-1-0-18494http://pedsovet.su/load/165-1-0-14780http://pedsovet.su/load/165-1-0-26067http://galina622.blogspot.com/2012/05/9.htmlhttp://festival.1september.ru/articles/527232/http://900igr.net/zip/khimija/Osnovnye-klassy-neorganicheskikh-soedinenij.htmlhttp://www.google.ru/url?sa=t&rct=j&q=%D0%9E%D0%BA
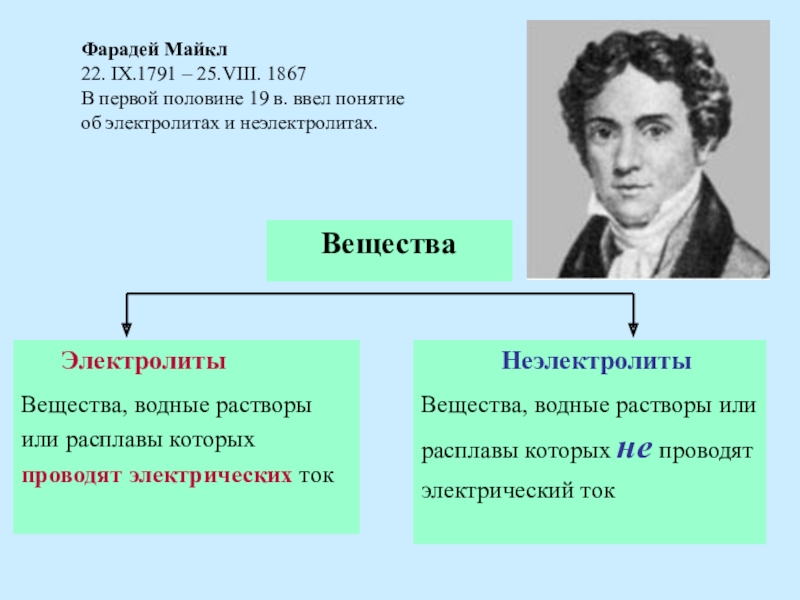
Слайд 2Фарадей Майкл
22. IX.1791 – 25.VIII. 1867
В первой половине 19 в. ввел
об электролитах и неэлектролитах.
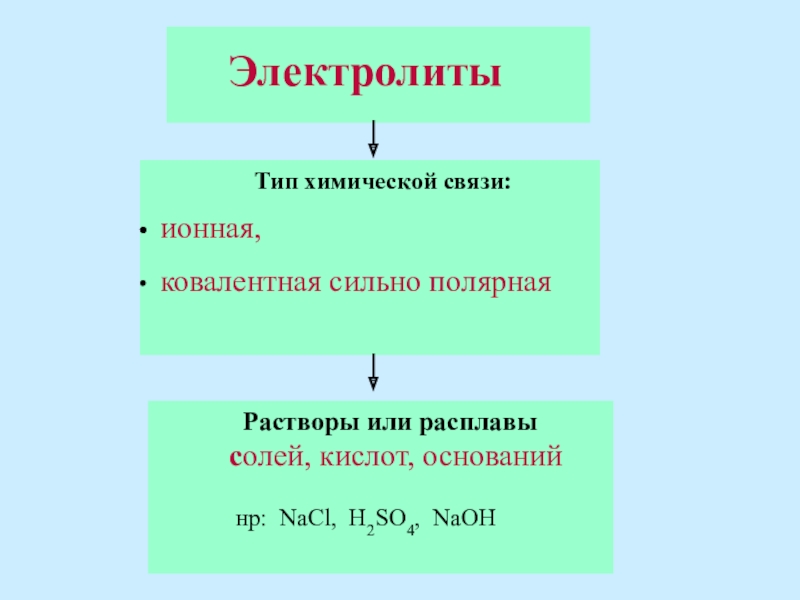
Слайд 3 Тип химической связи:
ковалентная сильно полярная
Электролиты
Растворы или расплавы
солей, кислот, оснований
нр: NaCl, H2SO4, NaOH
Слайд 4
Неэлектролиты
Тип
ковалентная неполярная ,
ковалентная малополярная
Кислород O2, азот N2, водород H2
многие органические вещества – спирты,
глюкоза, сахароза, бензол и др.
Слайд 5 Сванте Август Аррениус-
Автор теории электролитической
диссоциации (1887 г.)
В 1903 г. награжден Нобелевской премией.
Стр.5 учебника УМК Рудзитис Г.Е.
Фельдман Ф.Г.
Слайд 6 Русские химики И.А.Каблуков и В.А.Кистяковский применили к объяснению электролитической диссоциации химическую
Каблуков И.А.
Кистяковский В.А.
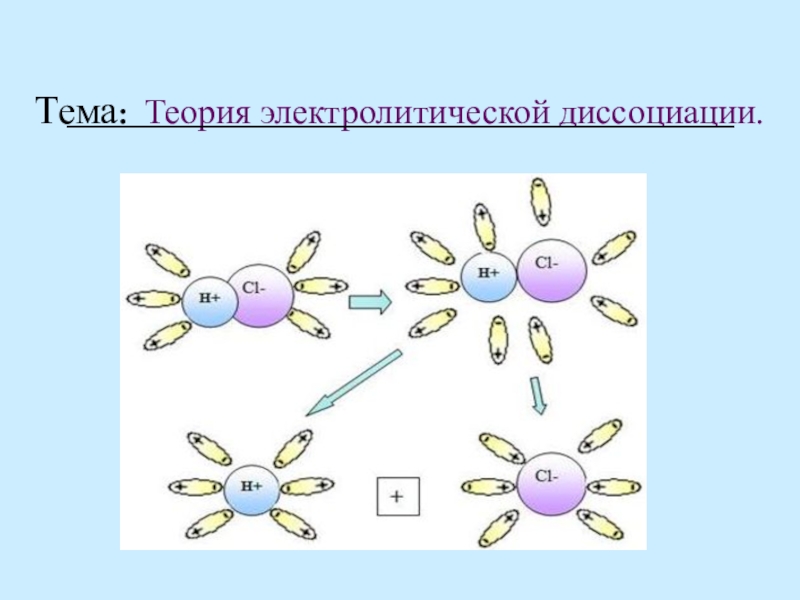
Слайд 7Механизм ЭД
ионных веществ
Ориентация диполей воды вокруг кристаллов соли.
Образование между
Разрушение кристаллической решетки и образование гидратированных ионов.
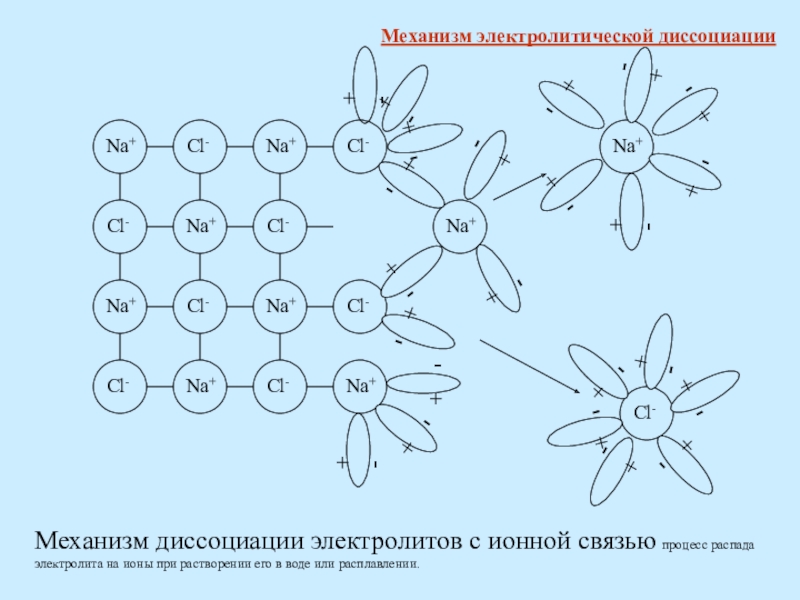
Слайд 8+ -
Механизм диссоциации электролитов с ионной связью процесс распада электролита
Механизм электролитической диссоциации
Слайд 10+ -
Механизм диссоциации электролитов с полярной связью
Механизм электролитической диссоциации
Слайд 11Электролитическая диссоциация веществ, идущая с образованием свободных ионов (катионов и анионов)
CaCl2 = Ca2+ + 2Cl-
KAl(SO4)2 = K+ + Al3+ + 2SO42-
HNO3 = H+ + NO3-
Ba(OH)2 = Ba2+ + 2OH-
Слайд 12K2CO3 ↔ 2K+ + CO32-
Дописать пример: Al2(SO4)3 ↔
Средние (нормальные)
образующие при диссоциации катионы металла и анионы кислотного остатка.
Кислоты, основания и соли с точки зрения ТЭД
Слайд 13 Кислоты, основания и соли с точки зрения ТЭД
Уравнение электролитической диссоциации
H2SO4 ↔ 2H+ + SO42-
Слабые многоосновные кислоты диссоциируют ступенчато.
H2CO3 ↔ H+ + …
HCO3- ↔ H+ + …
Кислоты – электролиты, которые при диссоциации образуют только один вид катионов – катионы водорода Н+
Слайд 14Уравнение диссоциации сильных оснований (щелочей)
Ba(OH)2 ↔ Ba2+ + 2OH-
Слабые многокислотные основания
Fe(OH)2 ↔ FeOH+ + …
FeOH+ ↔ Fe2+ + …
Основания - электролиты, которые при диссоциации образуют только один вид
анионов - гидроксид-ионы ОН-.
Кислоты, основания и соли с точки зрения ТЭД