- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Электролитическая диссоциация( 9 класс)
Содержание
- 1. Презентация по химии на тему Электролитическая диссоциация( 9 класс)
- 2. ПланЭлектролиты и неэлектролиты. Электролитическая диссоциация. Механизмы электролитической
- 3. Решить задачу:В 215 г воды растворили 25
- 4. Решение:
- 5. Электролитическая диссоциация - это процесс
- 6. Электролиты при растворении в воде или расплавлении распадаются (диссоциируют) на ионы – положительно (катионы) и отрицательно (анионы) заряженные частицы. В растворах и расплавах электролиты проводят электрический ток.
- 7. Неэлектролиты– это вещества, водные растворы или расплавы которых не проводят электрический ток
- 8. Слайд 8
- 9. Слайд 9
- 10. Диссоциация кислот Кислотами называются электролиты, при диссоциации которых
- 11. Диссоциация оснований (щелочей) Основаниями называются электролиты, при диссоциации
- 12. Диссоциация солей Солями называются электролиты, при диссоциации которых образуются
- 13. ЗАДАНИЕ ДЛЯ ЗАКРЕПЛЕНИЯ №1. Используя таблицу растворимости
- 14. ЗАДАНИЕ ДЛЯ ЗАКРЕПЛЕНИЯ№2. Используя таблицу растворимости солей, кислот,
- 15. Степень электролитической диссоциации.
- 16. электролитысильныеслабыеα>30%1. Растворимые соли;2. Сильные кислоты (НСl, HBr, HI, НNО3, НClO4, Н2SO4(разб.));3. Сильные основания – щёлочи.α
- 17. Основные положения теории электролитической диссоциации. Все вещества
ПланЭлектролиты и неэлектролиты. Электролитическая диссоциация. Механизмы электролитической диссоциации для веществ с различными типами химической связи. Степень электролитической диссоциации. Сильные и слабые электролиты. Основные положения теории электролитической диссоциации. Кислоты, основания и соли как электролиты.
Слайд 2План
Электролиты и неэлектролиты.
Электролитическая диссоциация.
Механизмы электролитической диссоциации для веществ с
различными типами химической связи.
Степень электролитической диссоциации.
Сильные и слабые электролиты.
Основные положения теории электролитической диссоциации.
Кислоты, основания и соли как электролиты.
Степень электролитической диссоциации.
Сильные и слабые электролиты.
Основные положения теории электролитической диссоциации.
Кислоты, основания и соли как электролиты.
Слайд 3Решить задачу:
В 215 г воды растворили 25 г соли. Вычислите массовую
долю растворенного вещества.
Дано:
m (H₂O) = 360 г
m (соли) = 25 г
----------------------------
Ѡ (соли) = ?
Дано:
m (H₂O) = 360 г
m (соли) = 25 г
----------------------------
Ѡ (соли) = ?
Слайд 4Решение:
m (соли) 25 г 25
1) Ѡ (соли) = ------------------------ = -------------- = --------- =
m (соли) + m (H₂O) 25 г + 360 г 385
= 0, 065 или 6,5 %
Ответ: Ѡ (соли) = 6,5 %
1) Ѡ (соли) = ------------------------ = -------------- = --------- =
m (соли) + m (H₂O) 25 г + 360 г 385
= 0, 065 или 6,5 %
Ответ: Ѡ (соли) = 6,5 %
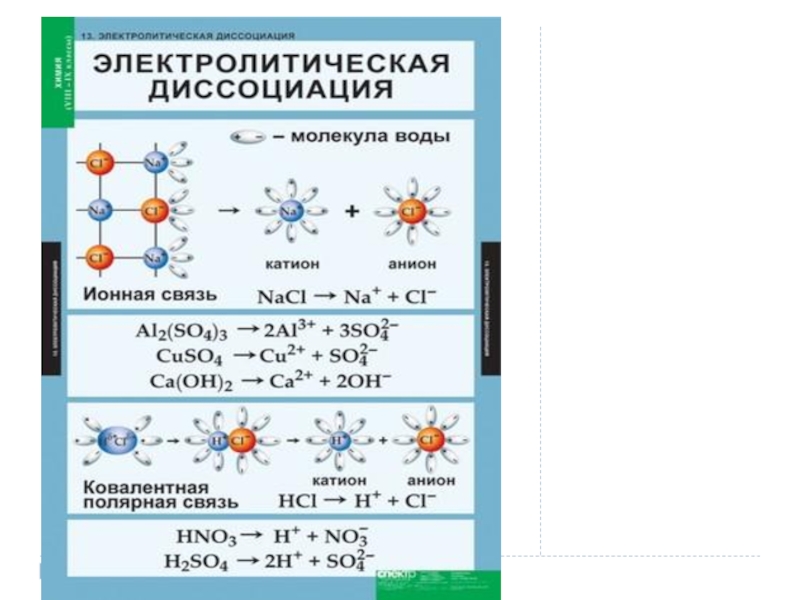
Слайд 5 Электролитическая диссоциация - это процесс распада электролита на ионы при растворении его
в воде или расплавлении.
Диссоциация хлорида натрия: NaCl = Na⁺ + Cl⁻
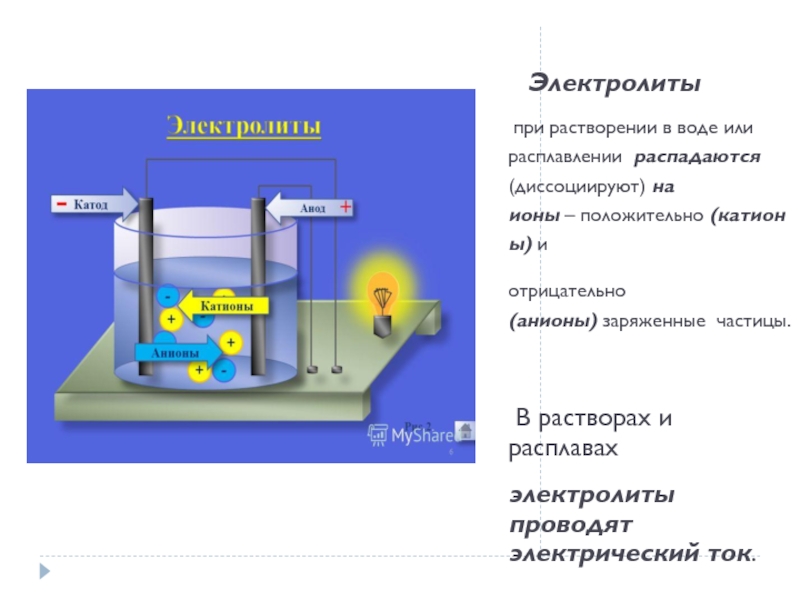
Слайд 6Электролиты
при растворении в воде или расплавлении распадаются (диссоциируют) на ионы – положительно (катионы) и
отрицательно (анионы) заряженные частицы.
В растворах и расплавах
электролиты проводят
электрический ток.
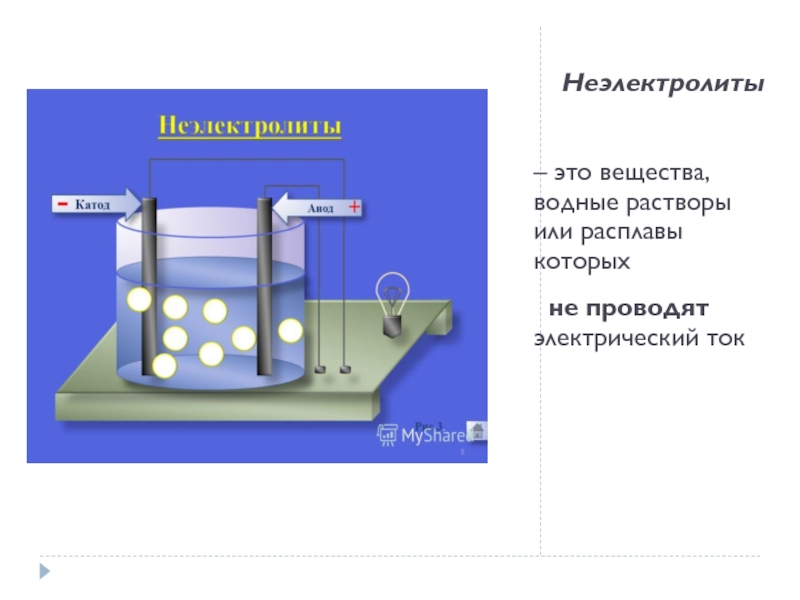
Слайд 7Неэлектролиты
– это вещества, водные растворы или расплавы которых
не проводят электрический ток
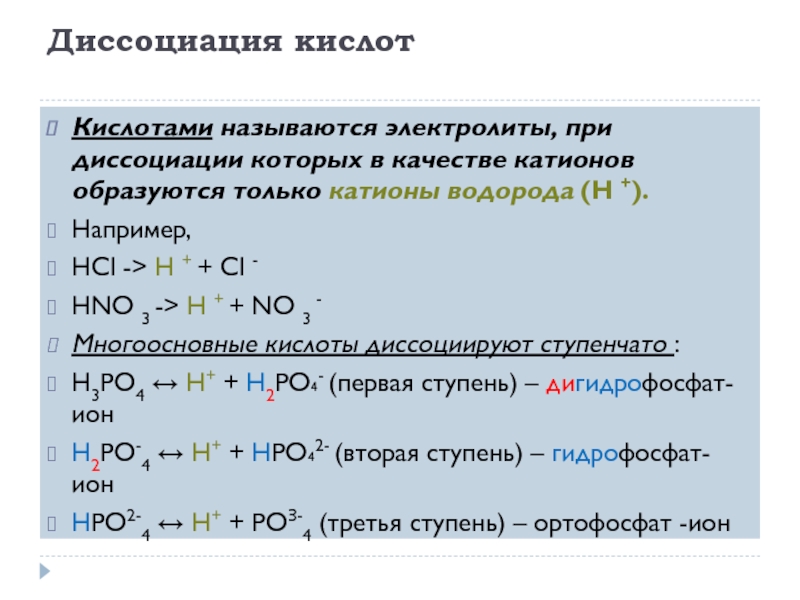
Слайд 10Диссоциация кислот
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только
катионы водорода (H +).
Например,
HCl -> H + + Cl -
HNO 3 -> H + + NO 3 -
Многоосновные кислоты диссоциируют ступенчато :
Н3РО4 ↔ Н+ + Н2РО₄- (первая ступень) – дигидрофосфат- ион
Н2РО-4 ↔ Н+ + НРO₄2- (вторая ступень) – гидрофосфат- ион
НРО2-4 ↔ Н+ + PОЗ-4 (третья ступень) – ортофосфат -ион
Например,
HCl -> H + + Cl -
HNO 3 -> H + + NO 3 -
Многоосновные кислоты диссоциируют ступенчато :
Н3РО4 ↔ Н+ + Н2РО₄- (первая ступень) – дигидрофосфат- ион
Н2РО-4 ↔ Н+ + НРO₄2- (вторая ступень) – гидрофосфат- ион
НРО2-4 ↔ Н+ + PОЗ-4 (третья ступень) – ортофосфат -ион
Слайд 11Диссоциация оснований (щелочей)
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются
только гидроксид-ионы (OH -).
KOH -> K + + OH -;
NH 4OH ↔ NH +4 + OH -
Многокислотные основания диссоциируют ступенчато:
Ba(ОН)2 -> Bа(ОН)+ + OH-(первая ступень)
Ba(OH)+ ↔ Ba2++ OH- (вторая ступень)
KOH -> K + + OH -;
NH 4OH ↔ NH +4 + OH -
Многокислотные основания диссоциируют ступенчато:
Ba(ОН)2 -> Bа(ОН)+ + OH-(первая ступень)
Ba(OH)+ ↔ Ba2++ OH- (вторая ступень)
Слайд 12Диссоциация солей
Солями называются электролиты, при диссоциации которых образуются катионы металлов, а также катион
аммония (NH+4) и анионы кислотных остатков.
Например, диссоциация средних солей :
(NH4)2SO4 -> 2NH₄++ SO₄2-;
Na3PO 4 -> 3 Na + + PO₄3-
Например, диссоциация средних солей :
(NH4)2SO4 -> 2NH₄++ SO₄2-;
Na3PO 4 -> 3 Na + + PO₄3-
Слайд 13ЗАДАНИЕ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Используя таблицу растворимости солей, кислот, оснований напишите уравнения
диссоциации следующих веществ:
HF, Mg(OH)2, CaCl2, Zn(NO3)2,Ba(OH)2, K2SO4, H2SiO3, FeI3, NiCl2, H3PO4
Слайд 14ЗАДАНИЕ ДЛЯ ЗАКРЕПЛЕНИЯ
№2. Используя таблицу растворимости солей, кислот, оснований напишите уравнения диссоциации
следующих веществ:
Ca(OH)2
Na2CO3
Na3PO4
HNO3
KOH
Ba(OH)2
H2SO3
Ca(NO3)2
Ca3(PO4)2
H2S
NaOH
HBr
Слайд 16электролиты
сильные
слабые
α>30%
1. Растворимые соли;
2. Сильные кислоты
(НСl, HBr, HI, НNО3, НClO4, Н2SO4(разб.));
3.
Сильные основания – щёлочи.
α<3%
1. Почти все органические кислоты (CH3COOH- уксусная и др.);
2. Некоторые неорганические кислоты (H2CO3, H2S и др.);
3. Почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca3(PO4)2; Cu(OH)2; Al(OH)3; NH4OH);
4. Вода.
Слайд 17Основные положения теории электролитической диссоциации.
Все вещества можно разделить на электролиты
и неэлектролиты.
Электролиты в растворах и расплавах распадаются на ионы.
Распад электролита на ионы зависит от степени электролитической диссоциации - α
Электролиты в растворах и расплавах распадаются на ионы.
Распад электролита на ионы зависит от степени электролитической диссоциации - α