- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Электролитическая диссоциация
Содержание
- 1. Презентация по химии на тему Электролитическая диссоциация
- 2. Электролитическая диссоциация (ЭД) – это физико-химический процесс,
- 3. История открытия теории электролитической диссоциации В
- 4. Основные положения ТЭДПри растворении в воде электролиты
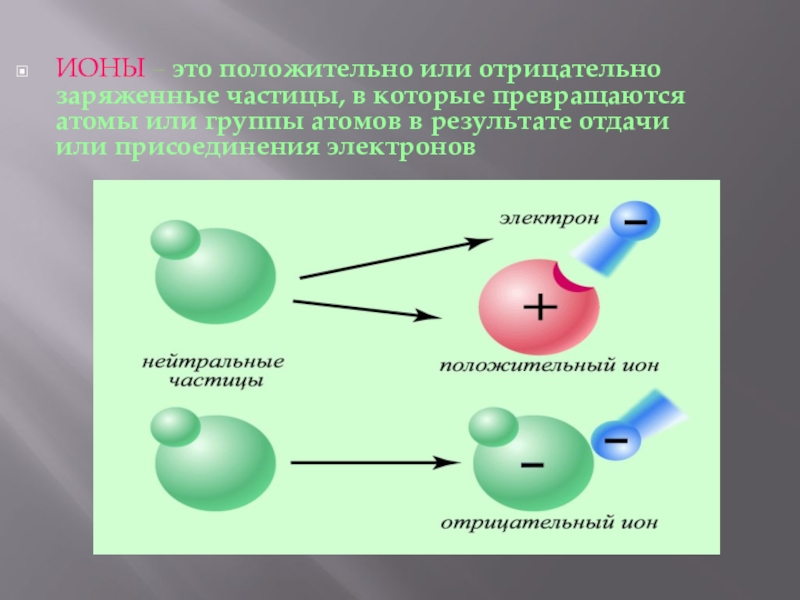
- 5. ИОНЫ – это положительно или отрицательно заряженные
- 6. ИОНЫ (по составу)ПРОСТЫЕНапример:Cl-K+СЛОЖНЫЕНапример:NO3-SO42-
- 7. Основные положения ТЭД2. Причиной диссоциации электролита в
- 8. Основные положения ТЭД3. Под действием электрического тока
- 9. ИОНЫ (по знаку заряда)КАТИОНЫ положительно заряженные частицыАНИОН отрицательно заряженные частицы
- 10. Основные положения ТЭД 4. Электролитическая диссоциация –
- 11. Основные положения ТЭД 5. Не все
- 12. Основные положения ТЭД6. Химические свойства растворов электролитов
- 13. Основания– это электролиты, при диссоциации которых в
- 14. При диссоциации щелочей образуются гидроксид ионы OH
- 15. Кислоты– это электролиты, при диссоциации которых в
- 16. Соли – это электролиты, которые при диссоциации
- 17. Слайд 17
- 18. ПРОВЕРЬ СВОИ ЗНАНИЯВещества, растворы которых проводят электрический
- 19. ПРОВЕРЬ СВОИ ЗНАНИЯ (дополните схему) ЭЛЕКТРОЛИТЫ(по степени электролитической диссоциации )
- 20. ПРОВЕРЬ СВОИ ЗНАНИЯ (дополните таблицу)
Электролитическая диссоциация (ЭД) – это физико-химический процесс, который может быть выражен уравнением AB ↔ A+ + B-A+ ионыB-
Слайд 2Электролитическая диссоциация (ЭД) – это физико-химический процесс, который может быть выражен
уравнением
AB ↔ A+ + B-
A+
ионы
B-
AB ↔ A+ + B-
A+
ионы
B-
Слайд 3История открытия теории электролитической диссоциации
В 1887 году шведский химик
Сванте Аррениус сформулировал основные положения теории электролитической диссоциации
Слайд 4Основные положения ТЭД
При растворении в воде электролиты диссоциируют (распадаются) на положительные
и отрицательные ионы.
NaCl = Na+ + Cl-
Ионы – это одна из форм существования химического элемента
NaCl = Na+ + Cl-
Ионы – это одна из форм существования химического элемента
Слайд 5ИОНЫ – это положительно или отрицательно заряженные частицы, в которые превращаются
атомы или группы атомов в результате отдачи или присоединения электронов
Слайд 7Основные положения ТЭД
2. Причиной диссоциации электролита в водном растворе является его
гидратация, т.е. взаимодействие электролита с молекулами воды и разрыв химической связи в нем.
Слайд 8Основные положения ТЭД
3. Под действием электрического тока положительно заряженные ионы
движутся к отрицательному полюсу источника тока – катоду, поэтому их называют катионами, а отрицательно заряженные ионы движутся к положительному полюсу источника тока – аноду, поэтому их называют анионами.
Слайд 9ИОНЫ
(по знаку заряда)
КАТИОНЫ
положительно заряженные частицы
АНИОН
отрицательно заряженные частицы
Слайд 10Основные положения ТЭД
4. Электролитическая диссоциация – процесс обратимый для слабых
электролитов.
Наряду с процессом диссоциации протекает и обратный процесс – ассоциация (соединение ионов)
HNO2 H+ + NO2-
Наряду с процессом диссоциации протекает и обратный процесс – ассоциация (соединение ионов)
HNO2 H+ + NO2-
Слайд 11Основные положения ТЭД
5. Не все электролиты в одинаковой мере
диссоциируют на ионы. ЭЛЕКТРОЛИТЫ
(по степени диссоциации)
СЛАБЫЕ СИЛЬНЫЕ
(по степени диссоциации)
СЛАБЫЕ СИЛЬНЫЕ
Слайд 12Основные положения ТЭД
6. Химические свойства растворов электролитов определяются свойствами тех ионов,
которые они образуют при диссоциации.
ЭЛЕКТРОЛИТЫ (по характеру образующихся ионов) КИСЛОТЫ ОСНОВАНИЯ
СОЛИ
ЭЛЕКТРОЛИТЫ (по характеру образующихся ионов) КИСЛОТЫ ОСНОВАНИЯ
СОЛИ
Слайд 13Основания– это электролиты, при диссоциации которых в качестве анионов образуются только
гидроксид-ионы
NaOH → Na+ + OH –
Ca(OH)2→Ca2+ + 2OH-
Слайд 14При диссоциации щелочей образуются гидроксид ионы OH -
Индикатор, изменяя цвет в
щелочной среде, обнаруживает наличие гидроксид ионов OH -
Слайд 15Кислоты– это электролиты, при диссоциации которых в качестве катионов образуются только
ионы водорода
H Cl →H+ + Cl-
H2SO4 →2H+ + HSO- 4
HSO- 4 →H+ + SO2- 4
!!! Диссоциация многоосновных кислот – процесс ступенчатый
Слайд 16Соли – это электролиты, которые при диссоциации образуют катионы металлов и
анионы кислотных остатков
KCl →K+ + Cl-
Na2SO4 → 2Na+ + SO2- 4
CaCl 2→Ca2+ +2 Cl-
В случае кислых солей диссоциация протекает ступенчато
Ca(HCO3)2→Ca2+ + HCO- 3
HCO- 3 → H+ + CO2- 3
Слайд 18ПРОВЕРЬ СВОИ ЗНАНИЯ
Вещества, растворы которых проводят электрический ток, называют ………
Процесс распада
электролита на ионы называют ……..
Вещества, растворы которых не проводят электрический ток, называют ……….
Отношение числа частиц, распавшихся на ионы, к общему числу растворенных частиц называют …………
Вещества, растворы которых не проводят электрический ток, называют ……….
Отношение числа частиц, распавшихся на ионы, к общему числу растворенных частиц называют …………