- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Электролитическая диссоциация и её разновидность - гидролиз (9 класс)
Содержание
- 1. Презентация по химии на тему Электролитическая диссоциация и её разновидность - гидролиз (9 класс)
- 2. Цели моей работы:
- 3. Задачи:Обработать теоретический материалРазработать и провести опытные исследования по изучению процесса электролиза и гидролиза
- 4. Почти все химические процессы, встречающиеся
- 5. Электролитическая диссоциация -
- 6. Распад на ионы раствора KMnO4 KMnO4?K+ + MnO4-
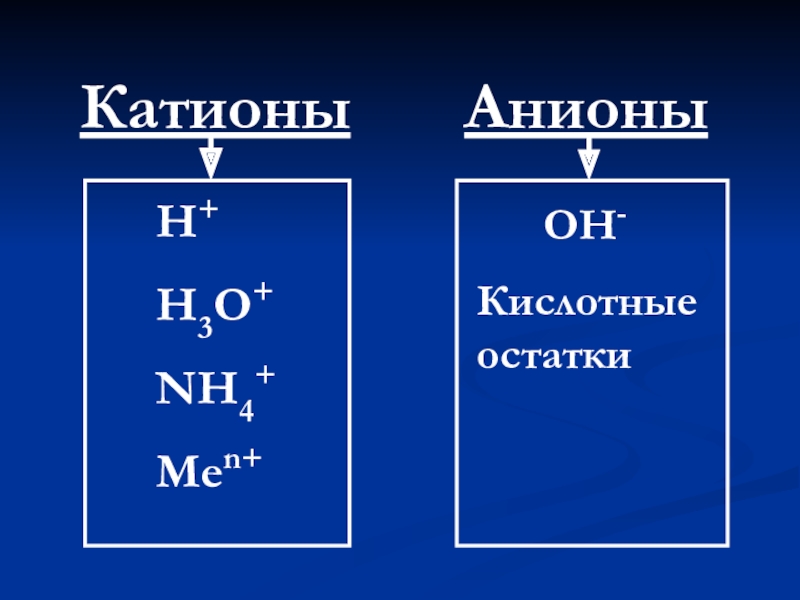
- 7. КатионыАнионыН+Н3О+NH4+Men+ OH-Кислотные остатки
- 8. В чём же суть электролитической диссоциации?
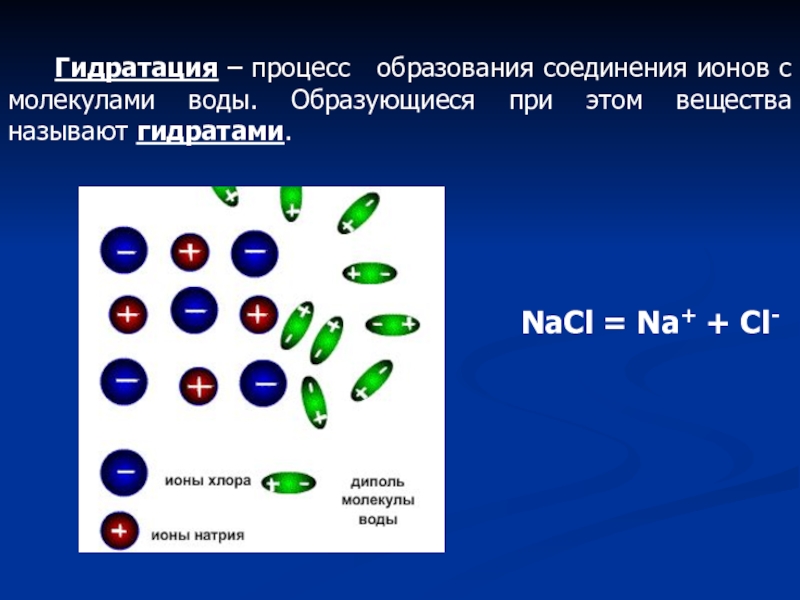
- 9. Гидратация – процесс
- 10. электролитынеэлектролитыРастворы
- 11. Электролиты. Электролиты – это вещества,
- 12. Неэлектролиты. Неэлектролиты – вещества, которые не
- 13. Степень электролитической диссоциации. Отношение числа молекул,
- 14. Слайд 14
- 15. Сильные электролиты. К сильным электролитам относятся те,
- 16. Слабые электролиты. Слабые электролиты имеют степень
- 17. Степень диссоциации (α) зависит от следующих факторов:от
- 18. Электролитическая диссоциация раствора солей. Соли –
- 19. Электролитическая диссоциация раствора оснований. Основания –
- 20. Электролитическая диссоциация растворов кислот. Кислоты диссоциируют
- 21. Реакции электролитической диссоциации идут
- 22. Осадок…BaCl2 + Na2SO4 = BaSO4? + 2NaClПИФ:
- 23. Осадок…2NaOH + CuSO4 = Na2SO4 + Cu(OH)2ПИФ:
- 24. Осадок…3NaOH + FeCl3 = 3NaCl + Fe(OH)3ПИФ:
- 25. Вода…HCl + NaOH = H2O + NaClПИФ:
- 26. Газ…СаСО3 + 2HCl = СаCl2 + СО2?
- 27. Гидролиз
- 28. Гидролиз (от греч.
- 29. CuSO4 ⮀ Cu2+ + SO42-H2O ⮀ H+
- 30. NaCl⮀ Na+ + Cl-H2O ⮀ H+ +
- 31. Na2CO3⮀ 2Na+ + CO32-H2O ⮀ H+ +
- 32. pH ≤ 7 Среда ближе к нейтральной
- 33. Гидролиз в организме.Гидролиз белка. Переваривание
- 34. Растворы имеют большое значение в нашей жизни!
- 35. Подводя итоги…В ходе работы:Изучен механизм процесса электролитической
- 36. Слайд 36
Слайд 1Московский департамент образования
Юго-Восточное окружное управление образования
средняя общеобразовательная школа № 1910
«Электролитическая диссоциация
Исполнитель: Гаврюшина Юлия Николаевна.
Руководитель: учитель химии - Кабанова Наталья Васильевна.
Москва 2009 г.
Слайд 2Цели моей работы:
Изучить механизм процесса электролиза и гидролиза
Выявить суть электролитической диссоциации
Создать опытный материл, подтверждающий процесс электролитической диссоциации и гидролиза
Слайд 3Задачи:
Обработать теоретический материал
Разработать и провести опытные исследования по изучению процесса электролиза
Слайд 4
Почти все химические процессы, встречающиеся в природе –
В. Освальд
Слайд 5
Электролитическая диссоциация - это процесс распада электролита
Электролитическая диссоциация –процесс, подтверждаемый проведением электрического тока раствором.
Слайд 9
Гидратация – процесс образования соединения ионов с
NaCl = Na+ + Cl-
Слайд 11
Электролиты.
Электролиты – это вещества, которые при растворении или расплавлении
Электролитами являются растворимые кислоты, соли и основания - вещества с ионными или полярными ковалентными связями.
Назад
Слайд 12Неэлектролиты.
Неэлектролиты – вещества, которые не проводят электрический ток.
Назад
Fe(OH)3?
крахмал
Слайд 13Степень электролитической диссоциации.
Отношение числа молекул, продиссоциировавших на ионы, к
α = n / N0
Где n – число молекул, распавшихся на ионы;
N0 – общее число молекул.
Слайд 15Сильные электролиты.
К сильным электролитам относятся те, степень диссоциации которых больше
30 % (α > 0,3).
Назад
К сильным электролитам относят вещества, практически полностью распадающиеся на ионы в растворе. К ним относят растворимые соли, сильные кислоты, растворимые основания кроме NH4OH .
Слайд 16Слабые электролиты.
Слабые электролиты имеют степень диссоциации меньше 2% (α
Назад
К слабым электролитам относят вещества, диссоциирующие в растворах незначительно. К ним относят слабые неорганические кислоты и все органические нерастворимые гидроксиды, а также растворимый гидроксид NH4OH, нерастворимые соли.
Слайд 17Степень диссоциации (α) зависит от следующих факторов:
от природы электролита, то есть
от природы растворителя – чем полярнее последний, тем легче идет в нем процесс диссоциации;
от температуры - повышение температуры усиливает диссоциацию;
от концентрации раствора – при разбавлении раствора диссоциация также увеличивается.
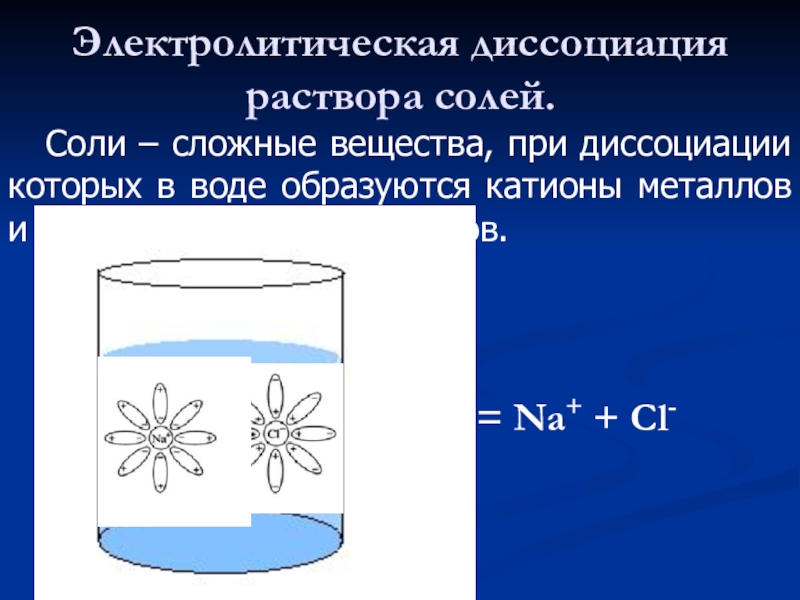
Слайд 18Электролитическая диссоциация раствора солей.
Соли – сложные вещества, при
NaCl = Na+ + Cl-
Слайд 19Электролитическая диссоциация раствора оснований.
Основания – сложные вещества, в
NaОН = Na+ + ОН-
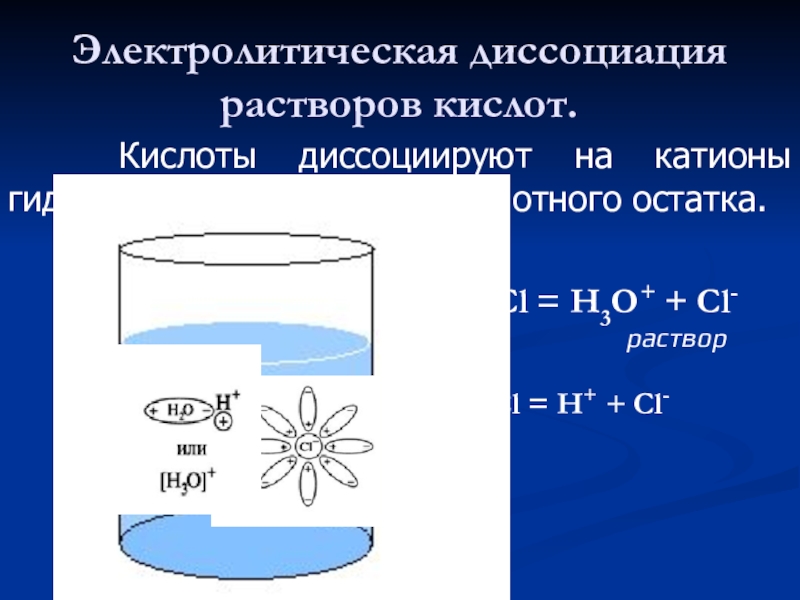
Слайд 20Электролитическая диссоциация растворов кислот.
Кислоты диссоциируют на катионы гидроксония
НCl = Н3О+ + Cl-
раствор
НCl = Н+ + Cl-
Слайд 21 Реакции электролитической диссоциации идут до конца и имеют
Слайд 22Осадок…
BaCl2 + Na2SO4 = BaSO4? + 2NaCl
ПИФ: Ba2+ + 2Cl- +
КИФ: Ba2+ + SO42- = BaSO4? Ʃ3
BaSO4? - осадок молочно-белого цвета
Слайд 23
Осадок…
2NaOH + CuSO4 = Na2SO4 + Cu(OH)2
ПИФ: 2Na + + 2OH-
КИФ: 2OH- + Cu2+ = Cu(OH)2? Ʃ4
⇨
Cu(OH)2? - гелеобразный
осадок синего цвета
Слайд 24Осадок…
3NaOH + FeCl3 = 3NaCl + Fe(OH)3
ПИФ: 3Na + + 3OH-
КИФ: 3OH- + Fe3+ = Fe(OH)3? Ʃ5
⇨
Fe(OH)3? - гелеобразный осадок
коричневого цвета
Слайд 25Вода…
HCl + NaOH = H2O + NaCl
ПИФ: H+ + Cl- +
КИФ: H+ + OH- = H2O Ʃ3
⇨
Слайд 26Газ…
СаСО3 + 2HCl = СаCl2 + СО2? + Н2О
ПИФ: СаСО3 +
КИФ: СаСО3 + 2H+ = Са2+ + СО2? + Н2О Ʃ6
⇨
Слайд 28 Гидролиз (от греч. hydro — вода и lysis —
Гидролизу подвергаются соединения различных классов: соли, углеводы, белки, сложные эфиры, жиры и т.д.
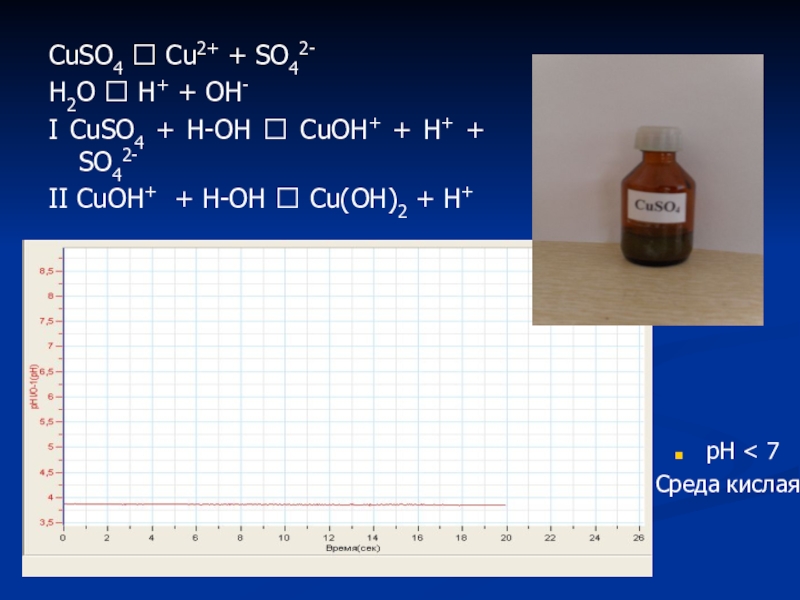
Слайд 29CuSO4 ⮀ Cu2+ + SO42-
H2O ⮀ H+ + OH-
I CuSO4 +
II CuOH+ + H-OH ? Cu(OH)2 + H+
pH < 7
Среда кислая
Слайд 30
NaCl⮀ Na+ + Cl-
H2O ⮀ H+ + OH-
NaCl + H-OH ?
pH ≥ 7
Среда ближе к
нейтральной
Слайд 31
Na2CO3⮀ 2Na+ + CO32-
H2O ⮀ H+ + OH-
I Na2CO3 + H-OH
II HCO3- +H-OH = CO2 + H2O + OH-
pH > 7
Среда щелочная
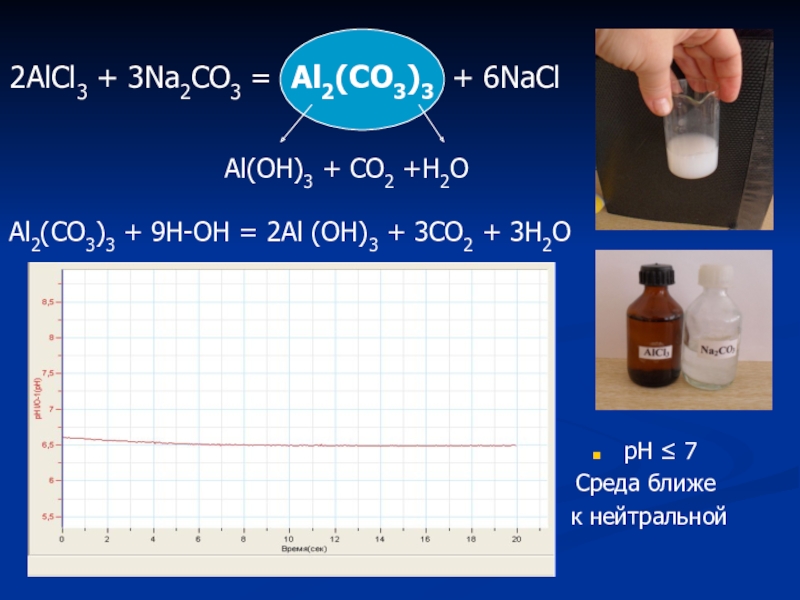
Слайд 32
pH ≤ 7
Среда ближе
к нейтральной
2AlCl3 + 3Na2CO3
Al(OH)3 + CO2 +H2O
Al2(CO3)3 + 9H-OH = 2Al (OH)3 + 3CO2 + 3H2O
Слайд 33Гидролиз в организме.
Гидролиз белка.
Переваривание пищевых белков – последовательность
Гидролиз белка (присоединение воды) – расщепление его до аминокислот с разрушением пептидной связи.
Слайд 35Подводя итоги…
В ходе работы:
Изучен механизм процесса электролитической диссоциации и её разновидности
Создан и обработан опытный материал, подтверждающий процесс электролитической диссоциации и гидролиза
Разработаны и проведены опытные исследования по изучению процесса электролитической диссоциации и её разновидности гидролиза.