ГБОУ Школа № 1352 г. Москвы.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Электролитическая диссоциация (9 класс)
Содержание
- 1. Презентация по химии на тему Электролитическая диссоциация (9 класс)
- 2. Электролитическая диссоциация Растворы и расплавы солей и
- 3. Электролитическая диссоциация Распад вещества на свободные ионы
- 4. Диссоциация (термин) «Диссоциация» распад«Ассоциация» объединение«Электролитическая» Распад приводит к электропроводности раствора или расплава
- 5. Диссоциация солей При электролитической диссоциации солей образуются катионы металла и анионы кислотного остатка.CaCl2=Ca2++2Cl-
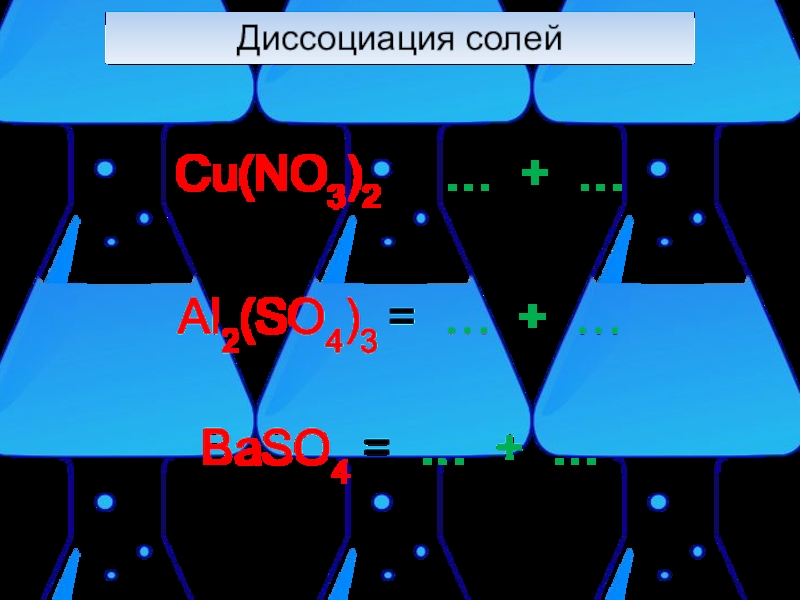
- 6. Диссоциация солей Cu(NO3)2 = … + …Al2(SO4)3 = … + …BaSO4 = … + …
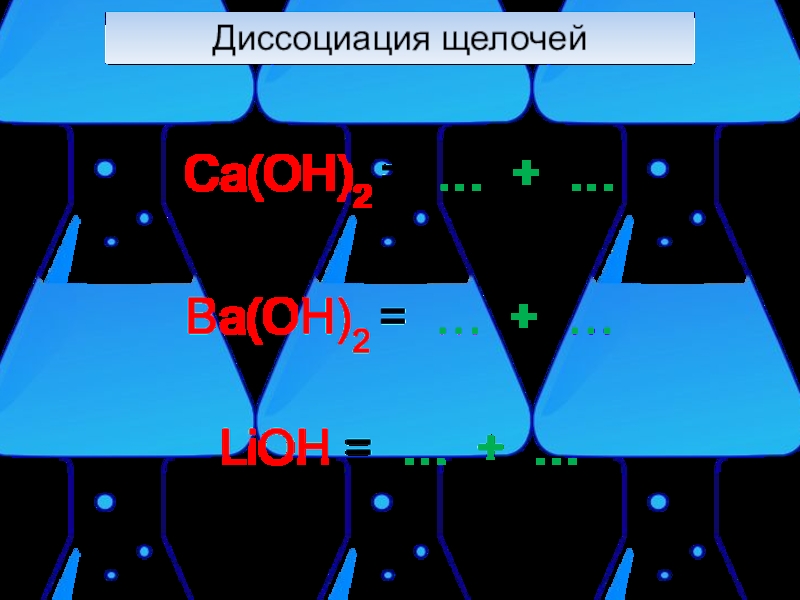
- 7. Диссоциация щелочей При электролитической диссоциации щелочей образуются катионы металлов и гидроксид-анионы (OH-).NaOH=Na++OH-
- 8. Диссоциация щелочей Ca(OH)2 = … + …Ba(OH)2 = … + …LiOH = … + …
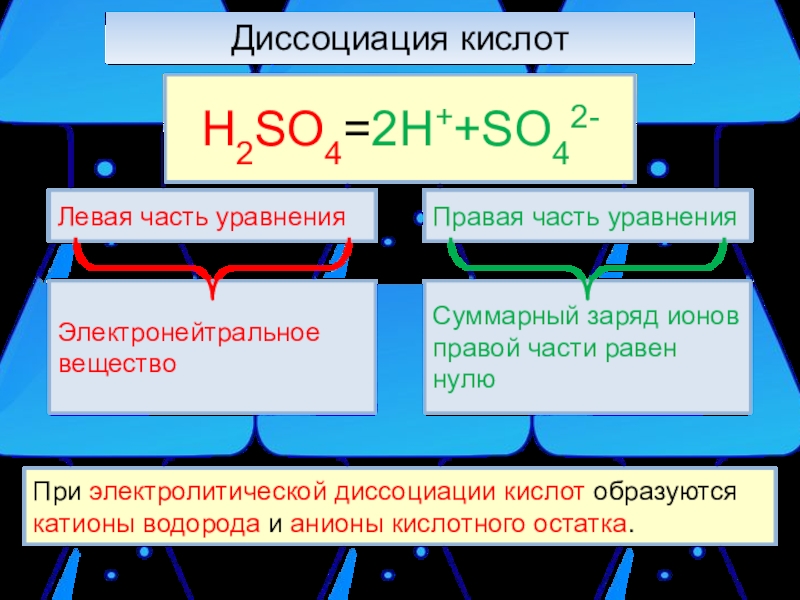
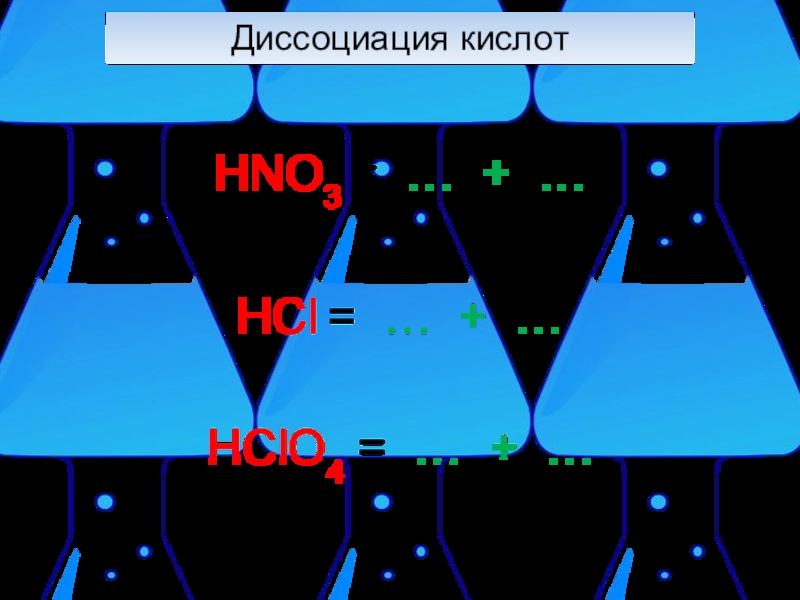
- 9. Диссоциация кислот При электролитической диссоциации кислот образуются катионы водорода и анионы кислотного остатка.H2SO4=2H++SO42-
- 10. Диссоциация кислот HNO3 = … + …HCl = … + …HClO4 = … + …
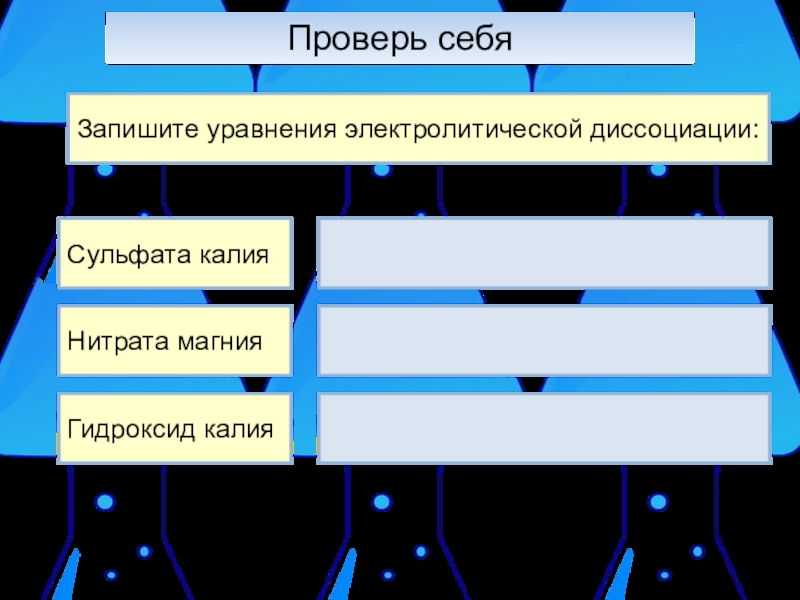
- 11. Проверь себяЗапишите уравнения электролитической диссоциации:Сульфата калияНитрата магнияГидроксид калия
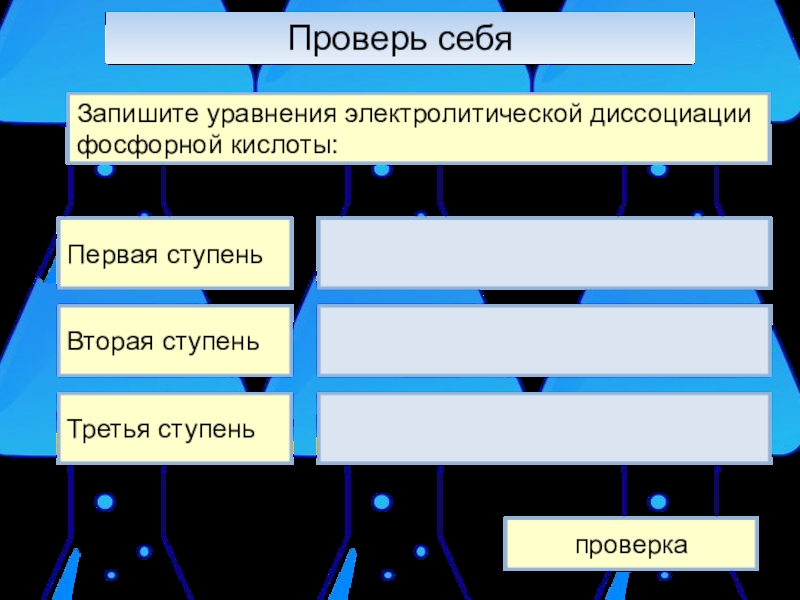
- 12. Проверь себяЗапишите уравнения электролитической диссоциации фосфорной кислоты:Первая ступеньВторая ступеньТретья ступеньпроверка
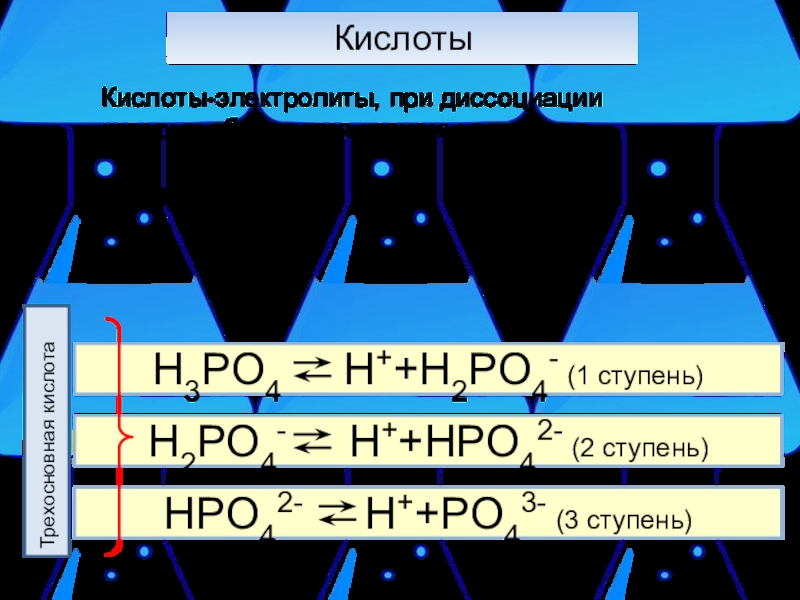
- 13. Кислоты Кислоты-электролиты, при диссоциации которых образуются катионы водорода. Пример: Трехосновная кислота
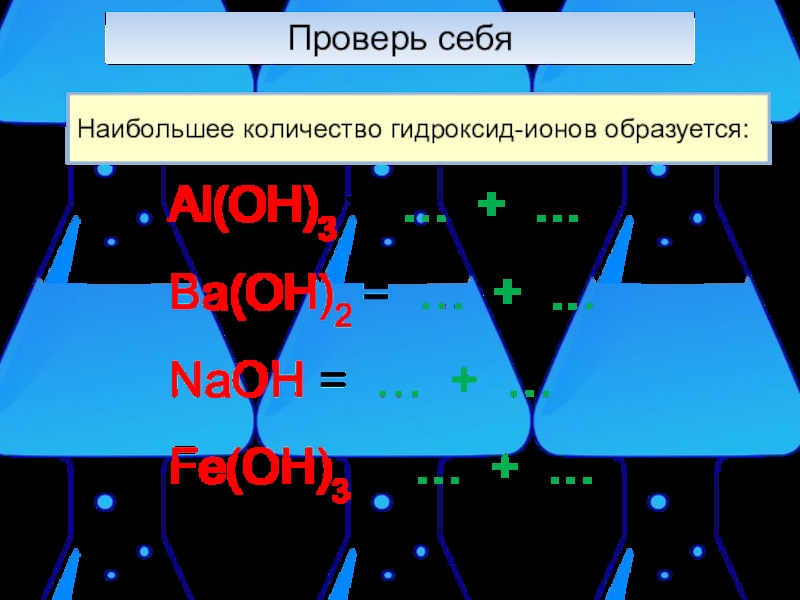
- 14. Проверь себяНаибольшее количество гидроксид-ионов образуется:Al(OH)3 = …
Слайд 1Электролитическая диссоциация
Урок 20, 9 класс, программа Оржековского П.А
Политова С.В, учитель химии
Слайд 2Электролитическая диссоциация
Растворы и расплавы солей и щелочей. А также растворы
При расплавлении вещества с ионным типом связи образуются свободные ионы (так же ионы образуются при растворении хлорида натрия в воде).
Пример: NaCl=Na++Cl-
Слайд 3Электролитическая диссоциация
Распад вещества на свободные ионы при его расплавлении или
NaCl=Na++Cl-
Уравнение электролитической диссоциации
пояснения
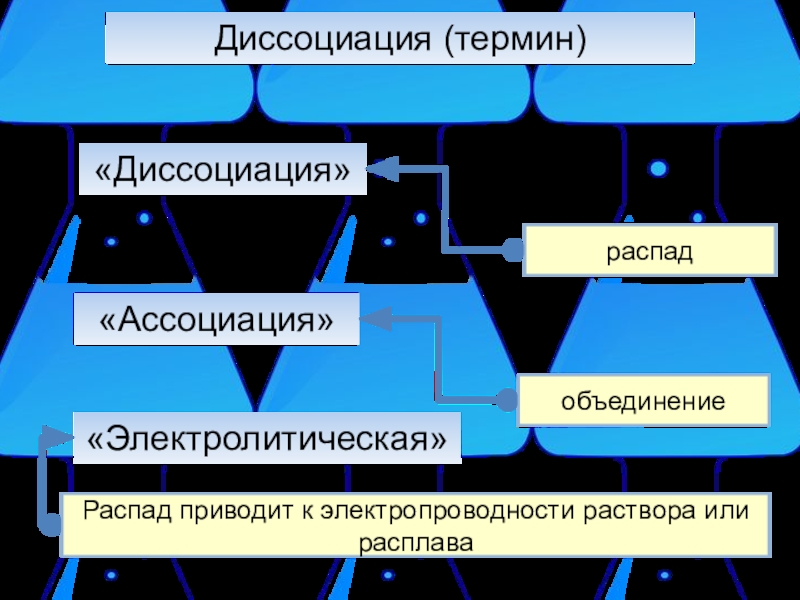
Слайд 4Диссоциация (термин)
«Диссоциация»
распад
«Ассоциация»
объединение
«Электролитическая»
Распад приводит к электропроводности раствора или
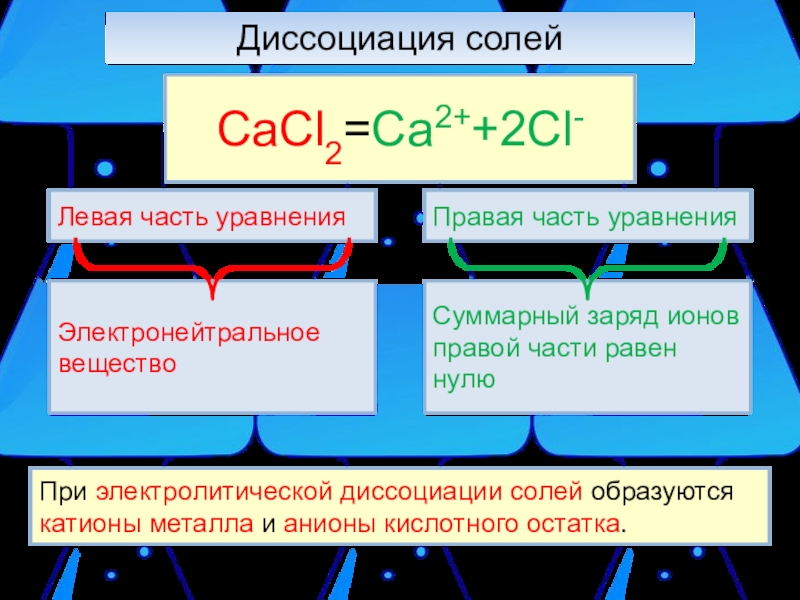
Слайд 5Диссоциация солей
При электролитической диссоциации солей образуются катионы металла и анионы
CaCl2=Ca2++2Cl-
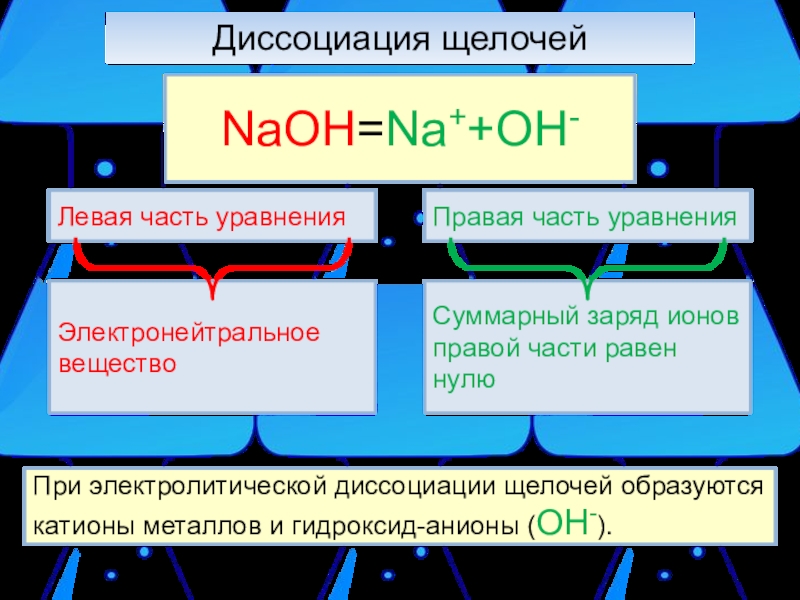
Слайд 7Диссоциация щелочей
При электролитической диссоциации щелочей образуются катионы металлов и гидроксид-анионы
NaOH=Na++OH-
Слайд 9Диссоциация кислот
При электролитической диссоциации кислот образуются катионы водорода и анионы
H2SO4=2H++SO42-
Слайд 11Проверь себя
Запишите уравнения электролитической диссоциации:
Сульфата калия
Нитрата магния
Гидроксид калия
Слайд 12Проверь себя
Запишите уравнения электролитической диссоциации фосфорной кислоты:
Первая ступень
Вторая ступень
Третья ступень
проверка
Слайд 13Кислоты
Кислоты-электролиты, при диссоциации которых образуются катионы водорода.
Пример:
Трехосновная кислота
Слайд 14Проверь себя
Наибольшее количество гидроксид-ионов образуется:
Al(OH)3 = … + …
Ba(OH)2 = …
NaOH = … + …
Fe(OH)3 = … + …