- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Единая природа химической связи
Содержание
- 1. Презентация по химии на тему: Единая природа химической связи
- 2. Цель: дать представление о причинах единства всех типов
- 3. Что
- 4. Любая химическая связь образуется только тогда, когда
- 5. Причина образования химической связи – стремление системы
- 6. Войнова Т.А. МОУ "Лицей "Эрудит" г.Рубцовск Алтайский край
- 7. Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
- 8. Важнейшим фактором характеристики атома является его электроотрицательностьВойнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
- 9. Определение типа связи(по ЭО):Равная ЭО – ковалентная
- 10. Кристаллические решётки веществ – это упорядоченное расположение
- 11. Ионные Ионными называют кристаллические решетки, в узлах
- 12. Атомные Атомными называют кристаллические решётки, в узлах
- 13. Молекулярные Молекулярными называют кристаллические решётки, в узлах
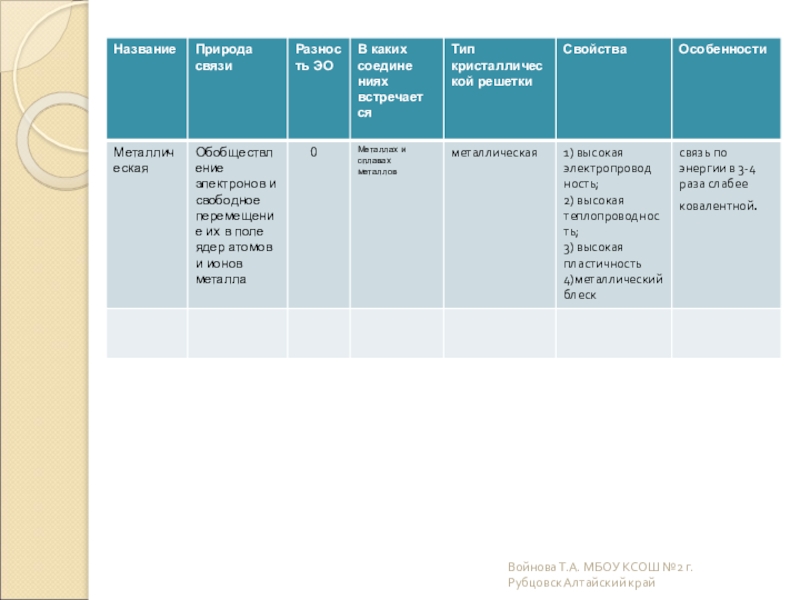
- 14. Металлические Металлическими называют решётки, в узлах которых
- 15. Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
- 16. Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
- 17. Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
- 18. Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
- 19. Какова природа возникновения химической связи?Электронно-ядерное взаимодействие атомов,
- 20. N H H H Cl - [
- 21. В зависимости от условий,возможен переход от одного
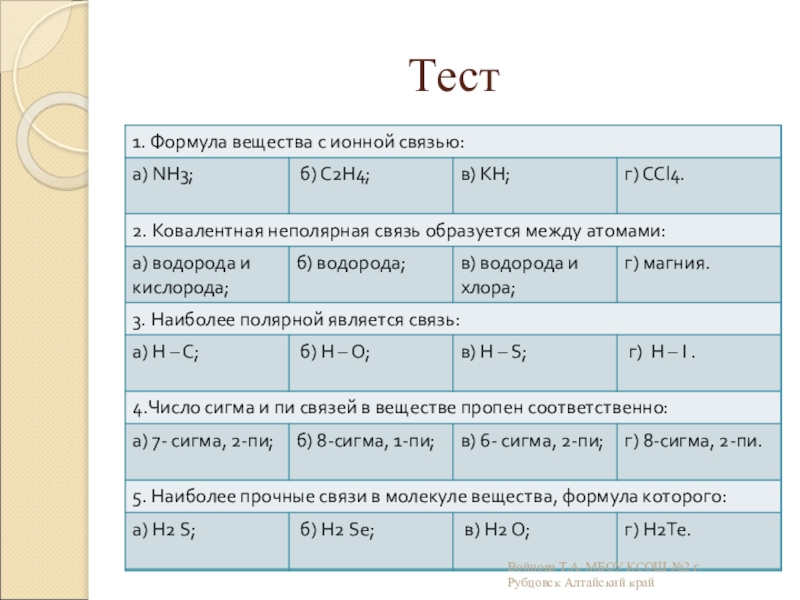
- 22. Тест Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
- 23. ТестВойнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
- 24. Самопроверкав бббвбаабВойнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
- 25. Рефлексия: что? какой? зачем?Домашнее задание:- повторить §
- 26. Учебно-методический комплектГабриелян О.С., Лысова Г.Г., . Общая
Слайд 2Цель:
дать представление о причинах единства всех типов химической связи
Задачи.
Образовательная: углубить и
дать более полное представление о всех типах кристаллических решеток ;
Развивающая: научить характеризовать химические связи по определенному плану;
научить соотносить зависимость физических и химических свойств веществ от вида химической связи и типа кристаллической решетки.
Воспитательная: развивать представления о взаимосвязи, взаимозависимости явлений окружающего мира.
Медиасоставляющая: используя различные справочники, дополнительную литературу, интернет ресурсы, материалы CD дисков, презентацию – сформировать целостное представление о химической связи.
Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
Слайд 3
Что такое химическая связь?
Какова природа химической связи?
Войнова Т.А. МБОУ КСОШ №2
Слайд 4
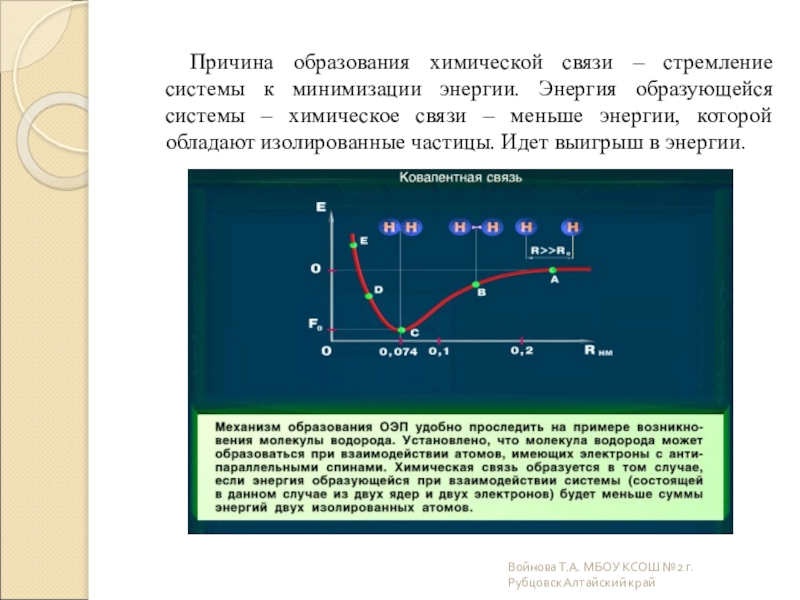
Любая химическая связь образуется только тогда, когда сближение частиц приводит к
Определяющим является:
энергия взаимодействия – Е
межъядерное расстояние – r
Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
Слайд 5Причина образования химической связи – стремление системы к минимизации энергии. Энергия
Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
Слайд 8
Важнейшим фактором характеристики атома является его электроотрицательность
Войнова Т.А. МБОУ КСОШ №2
Слайд 9Определение типа связи(по ЭО):
Равная ЭО – ковалентная неполярная;
Разность ЭО < 1,7
Разность ЭО > 1,7 – ионная связь;
Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
Слайд 10Кристаллические решётки веществ – это упорядоченное расположение частиц(атомов, молекул, ионов) в
В зависимости от типа частиц, расположенных в узлах кристаллической решётки, и характера связи между ними различают 4 типа кристаллических решёток: ионные, атомные, молекулярные, металлические. Рассмотрим каждую из решёток в отдельности и поподробней.
Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
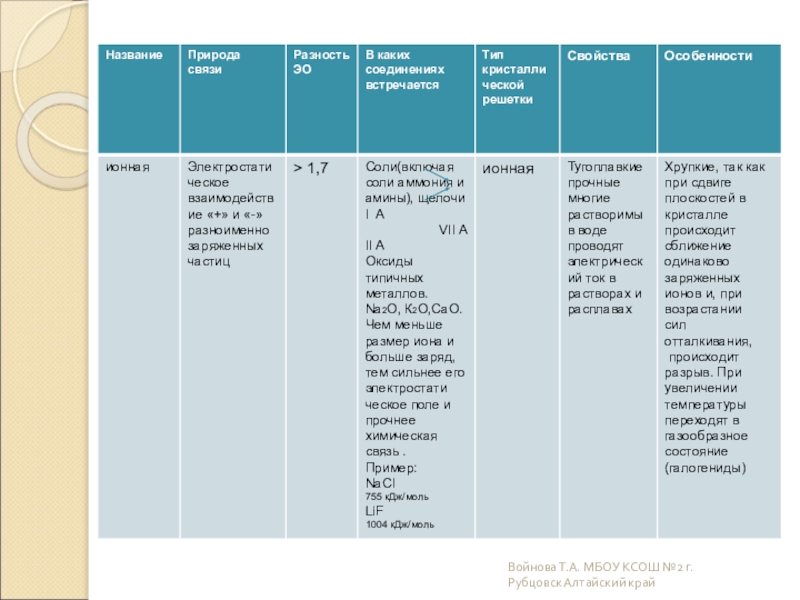
Слайд 11Ионные
Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их
Рассмотрим строение кристалла поваренной соли, в узлах которого находятся ионы хлора и натрия.
Связи между ионами в кристалле очень прочные и устойчивые. Поэтому вещества с ионной решёткой обладают высокой твёрдостью и прочностью, тугоплавки и нелетучи.
Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
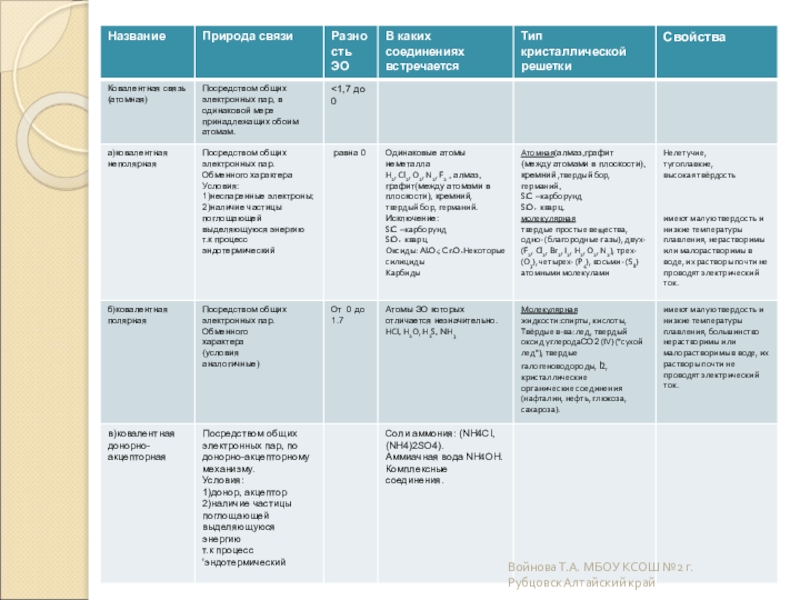
Слайд 12Атомные
Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы,
В природе встречается немного веществ с атомной кристаллической решёткой. К ним относятся бор, кремний, германий, кварц, алмаз. Вещества с АКР имеют высокие температуры плавления, обладают повышенной твёрдостью. Алмаз-самый твёрдый природный материал.
Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
Слайд 13Молекулярные
Молекулярными называют кристаллические решётки, в узлах которых располагаются молекулы. Химические
Вещества с МКР имеют малую твёрдость, плавятся при низкой температуре, летучие, при обычных условиях находятся в газообразном или жидком состоянии
Войнова Т.А. МОУ "Лицей "Эрудит" г.Рубцовск Алтайский край
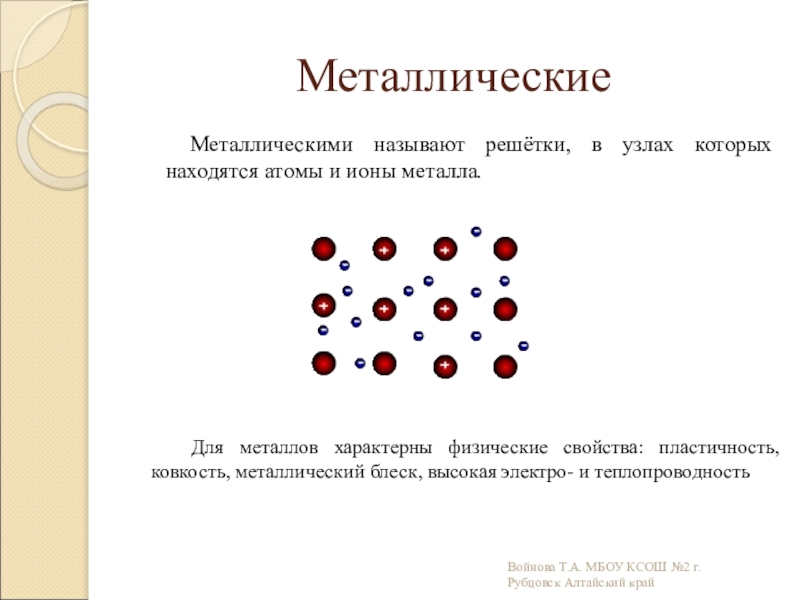
Слайд 14Металлические
Металлическими называют решётки, в узлах которых находятся атомы и ионы
Для металлов характерны физические свойства: пластичность, ковкость, металлический блеск, высокая электро- и теплопроводность
Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
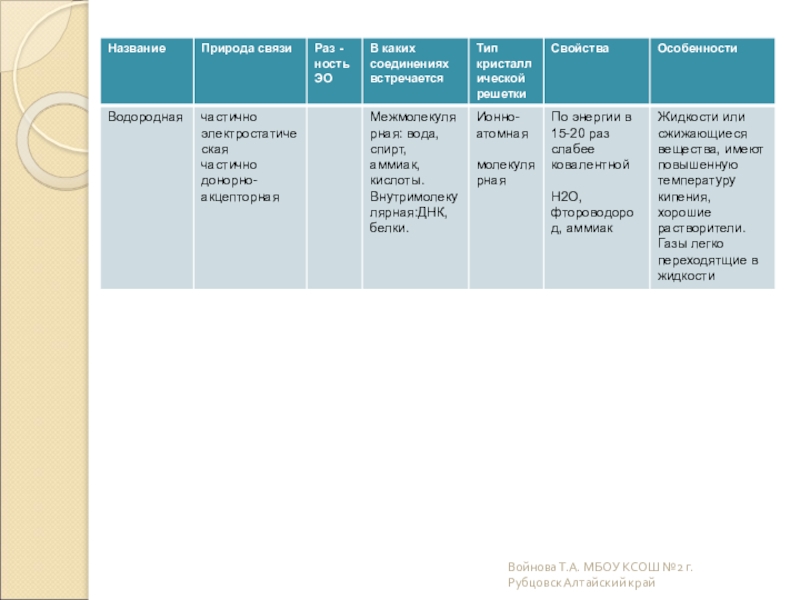
Слайд 19Какова природа возникновения химической связи?
Электронно-ядерное взаимодействие атомов, сопровождающееся выделением энергии
Часто встречаются
Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
Слайд 20N
H
H
H
Cl
-
[
[
*
*
*
*
*
.
.
.
H
N
H
H
[
*
.
.
+
ковалентная полярная
донорно-акцепторная
ионная связь
Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
Слайд 21В зависимости от условий,возможен переход от одного вида связи в другой:
При
При испарении металлов, металлическая связь превращается в ковалентную.
В органической химии, ковалентная неполярная связь Br2, при его взаимодействии с непредельными углеводородами становится ионной
План характеристики химической связи:
Вид химической связи(учитывая ЭО элементов)
Механизм их образования
Какие возникают связи δ, π, кратность связи
Соответствующий тип кристаллической решетки, физические свойства данного вещества
Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
Слайд 25Рефлексия: что? какой? зачем?
Домашнее задание:
- повторить § 6;
- выполнить упр. 3,4,6
гл.3 Кузьменко. Вопросы 84-112
Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
Слайд 26Учебно-методический комплект
Габриелян О.С., Лысова Г.Г., . Общая химия.11класс., -М.: Дрофа, 2006.
Габриелян О.С., Лысова Г.Г., Химия. 11 класс. Методическое пособие в 2х частях., - М.: Дрофа, 2003.
Горковенко М.Ю. Поурочные разработки по химии 11 класс., - М.: Вако. 2005.
Лидин Р.А. и др. Химия для школьников старших классов и поступающих в вузы. - М.: Дрофа, 2004.
Троегубова Н.П. Поурочные разработки по химии. – М.:Дрофа, 2009.
Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край