- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Белки и их свойства
Содержание
- 1. Презентация по химии на тему Белки и их свойства
- 2. Жизнь - это способ существования белковых тел…Ф. Энгельс
- 3. Ф.Энгельс Ф.Энгельс писал: “Повсюду, где
- 4. Начальные этапы в химии белкаБелок попал в
- 5. К началу XIX столетия появляются первые работы
- 6. Теории строения белков1.Теория протеина Г. Мульдер 1836г.2.
- 7. Лайнус Полинг В 1934г.
- 8. Широкое использование физических методов, в первую очередь
- 9. Первичная структура представляет собой линейную
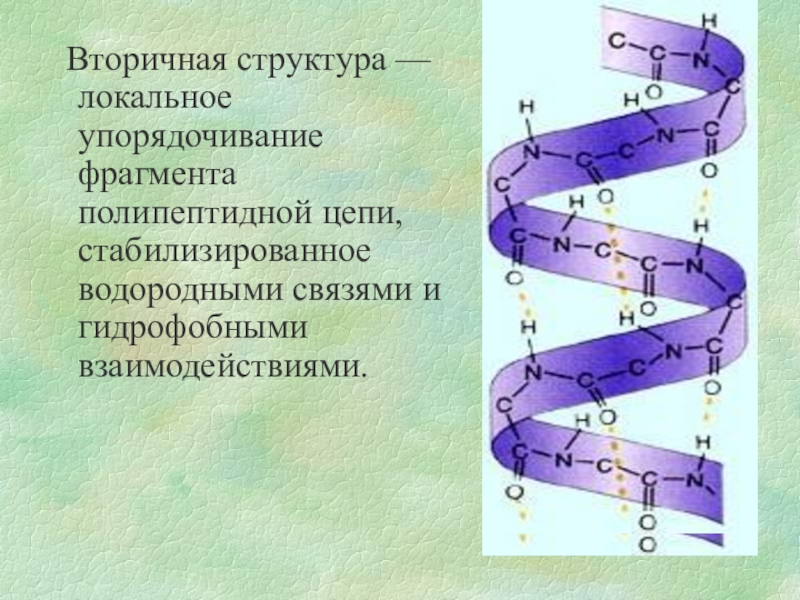
- 10. Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями и гидрофобными взаимодействиями.
- 11. Третичная стуктура-это реальная трехмерная конфигурация,
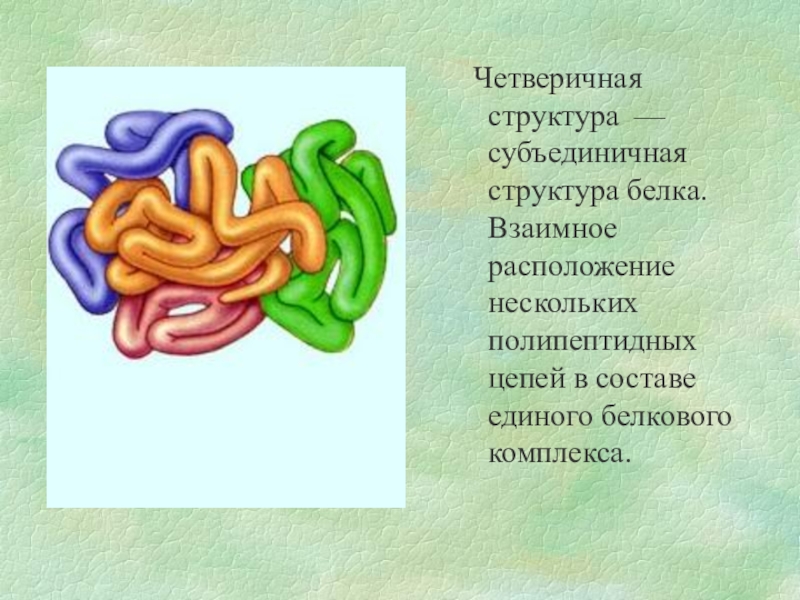
- 12. Четверичная структура — субъединичная структура белка.
- 13. Классификация белковНет рациональной химической классификации белков. Существующая
- 14. Классификация белков4 признакБиологическая активностьБ Е Л К
- 15. Слайд 15
- 16. Химические свойства белков
- 17. Денатурация. Резкое изменение условий, например, нагревание
- 18. Цветные реакции белковКачественные реакции на остатки аминокислот
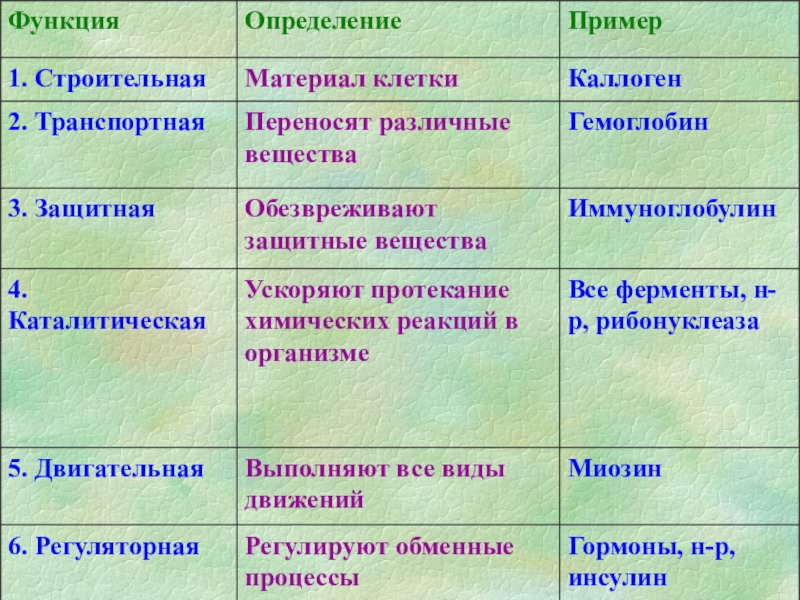
- 19. Функция качественных реакцийДля аминокислот, постоянно встречающихся в
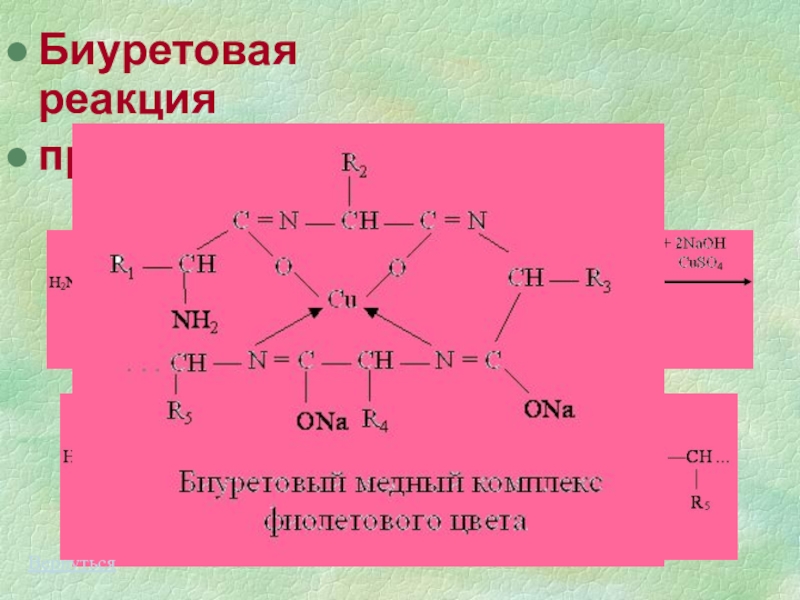
- 20. Биуретовая реакция Определяет наличие пептидной связи в растворе исследуемого соединения.пептидная связь
- 21. Биуретовая реакция протекает так:+CuSO4+NaOHВернуться
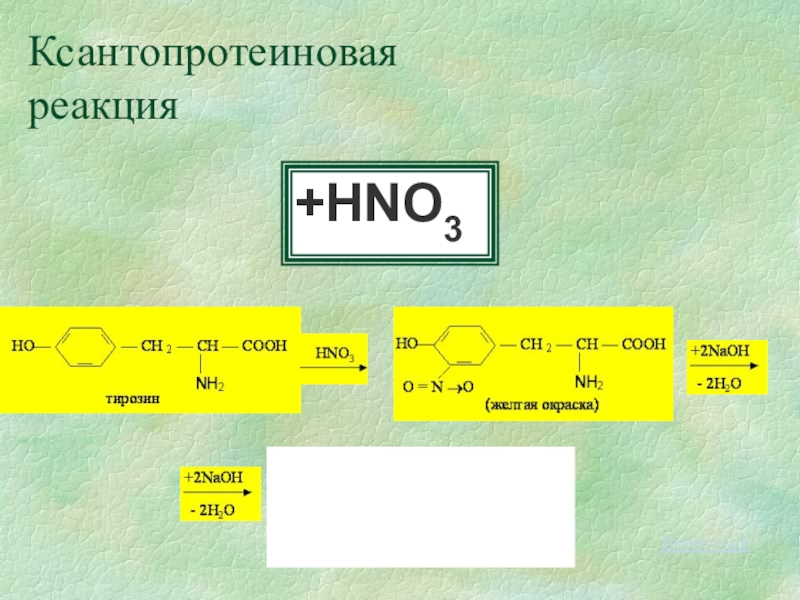
- 22. Ксантопротеиновая реакцияОпределяет присутствие в белке ароматических и
- 23. Ксантопротеиновая реакция+HNO3Вернуться
- 24. Цистеиновая реакцияОпределяет наличие сульфидных мостиков S-S в растворе исследуемого соединения. NaOH +Pb(CH3СОО)2
- 25. Закрепление изученного материалаОсуществи цепочку превращений1. метан
- 26. Домашнее задание:§§44 Цепочка в тетради.
- 27. Спасибо за внимание
Слайд 3Ф.Энгельс
Ф.Энгельс писал: “Повсюду, где мы втречаем жизнь, мы
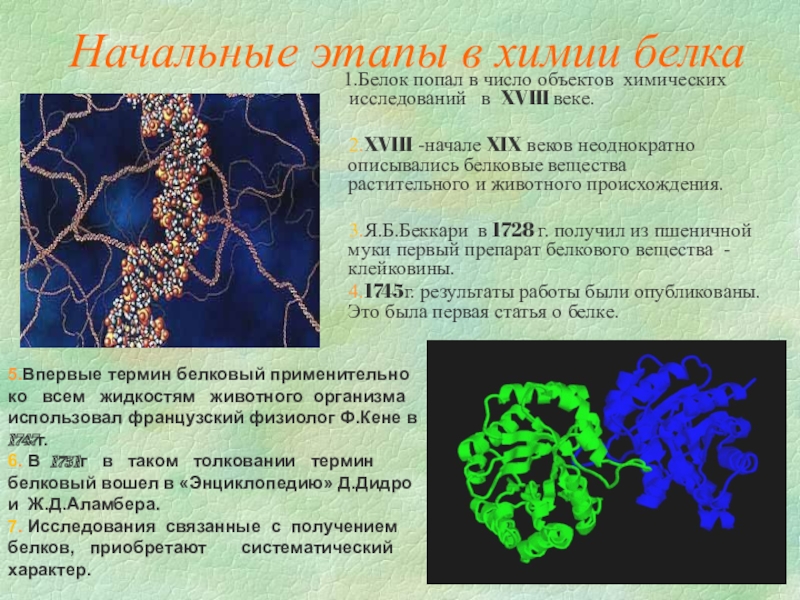
Слайд 4Начальные этапы в химии белка
Белок попал в число объектов химических исследований
2.XVIII -начале XIX веков неоднократно описывались белковые вещества растительного и животного происхождения.
3.Я.Б.Беккари в 1728 г. получил из пшеничной муки первый препарат белкового вещества - клейковины.
4.1745г. результаты работы были опубликованы.Это была первая статья о белке.
5.Впервые термин белковый применительно
ко всем жидкостям животного организма использовал французский физиолог Ф.Кене в 1747г.
6. В 1751г в таком толковании термин
белковый вошел в «Энциклопедию» Д.Дидро
и Ж.Д.Аламбера.
7. Исследования связанные с получением
белков, приобретают систематический характер.
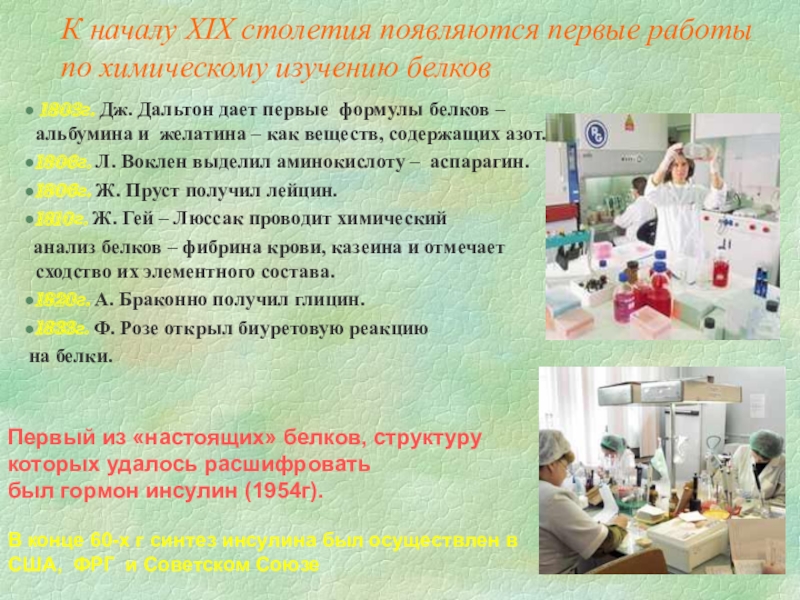
Слайд 5К началу XIX столетия появляются первые работы по химическому изучению белков
1806г. Л. Воклен выделил аминокислоту – аспарагин.
1806г. Ж. Пруст получил лейцин.
1810г. Ж. Гей – Люссак проводит химический
анализ белков – фибрина крови, казеина и отмечает сходство их элементного состава.
1820г. А. Браконно получил глицин.
1833г. Ф. Розе открыл биуретовую реакцию
на белки.
Первый из «настоящих» белков, структуру
которых удалось расшифровать
был гормон инсулин (1954г).
В конце 60-х г синтез инсулина был осуществлен в
США, ФРГ и Советском Союзе
Слайд 6Теории строения белков
1.Теория протеина Г. Мульдер 1836г.
2. Теория « углеазотных комплексов»
А.Я. Данилевского ( 80-е гг. XIX в.)
3. Теория «киринов» А. Косселя(1903г.)
4. Пептидная теория Э. Фишера
во многом подтвердившаяся
практически и получившая всеобщее
признание еще при его жизни. Он
был удостоен Нобелевской премии.
А.Я. Данилевский
Э. Фишер
Слайд 7
Лайнус Полинг
В 1934г. Лайнус Полинг совместно с
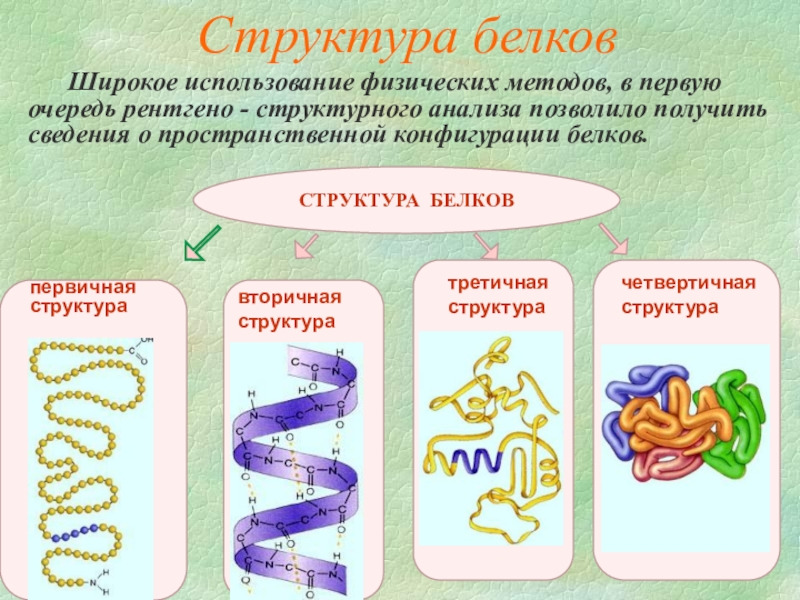
Слайд 8Широкое использование физических методов, в первую очередь рентгено - структурного анализа
Структура белков
СТРУКТУРА БЕЛКОВ
первичная
структура
вторичная
структура
третичная
структура
четвертичная
структура
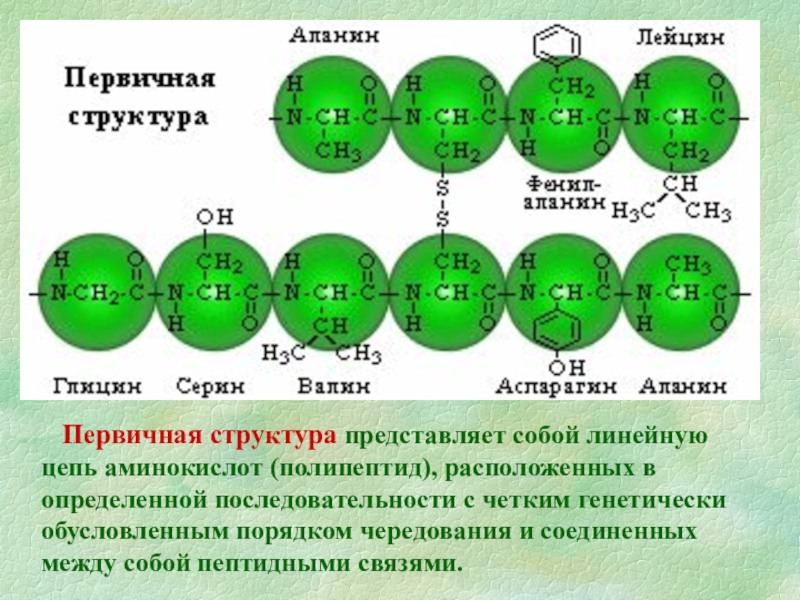
Слайд 9 Первичная структура представляет собой линейную цепь аминокислот (полипептид), расположенных
Слайд 10 Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными
Слайд 11 Третичная стуктура-это реальная трехмерная конфигурация, которую принимает в пространстве
Слайд 12 Четверичная структура — субъединичная структура белка. Взаимное расположение нескольких полипептидных
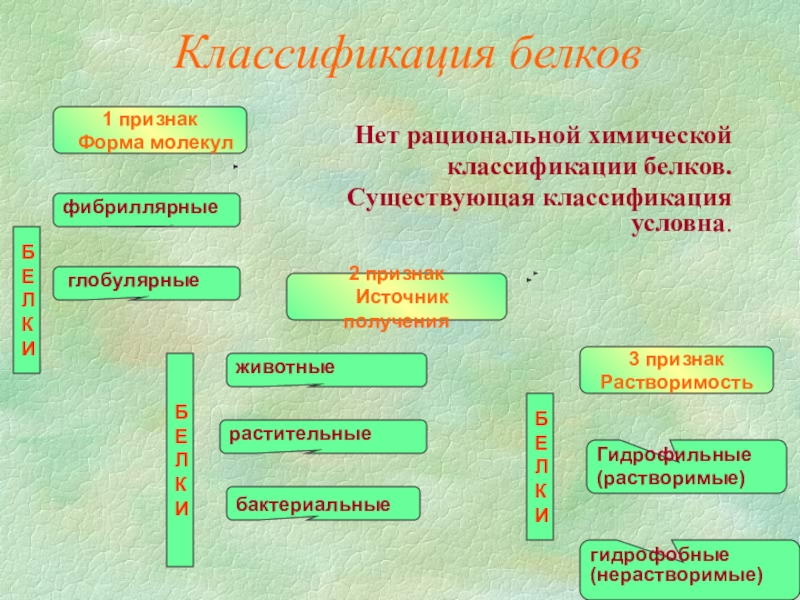
Слайд 13Классификация белков
Нет рациональной химической
классификации белков.
Существующая классификация условна.
Б
Е
Л
К
И
фибриллярные
глобулярные
1 признак
Форма молекул
3 признак
Растворимость
Б
Е
Л
К
И
Гидрофильные
(растворимые)
гидрофобные
(нерастворимые)
2 признак
Источник получения
Б
Е
Л
К
И
животные
растительные
бактериальные
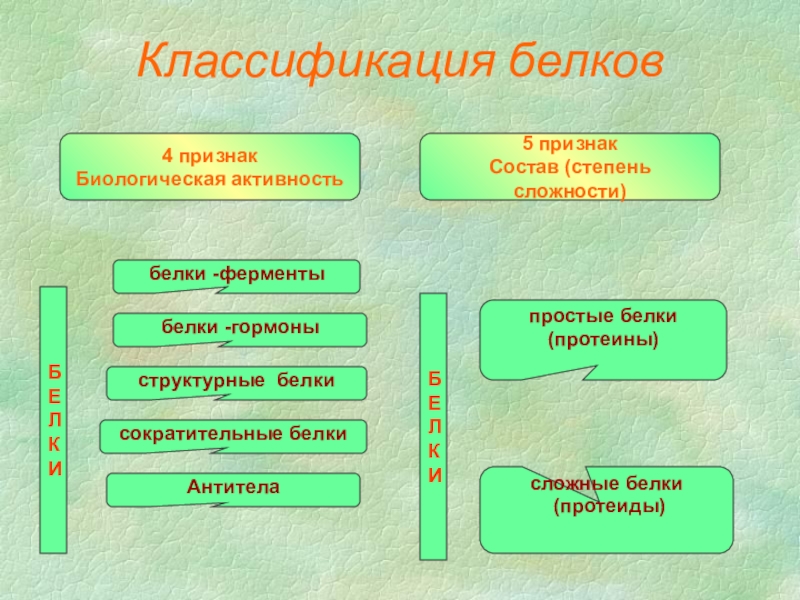
Слайд 14Классификация белков
4 признак
Биологическая активность
Б
Е
Л
К
И
белки -ферменты
белки -гормоны
структурные белки
сократительные белки
Антитела
5 признак
Состав (степень
Б
Е
Л
К
И
простые белки
(протеины)
сложные белки
(протеиды)
Слайд 17Денатурация.
Резкое изменение условий, например, нагревание или обработка белка кислотой
Слайд 19Функция качественных реакций
Для аминокислот, постоянно встречающихся в составе белков, разработано множество
Надо помнить, что все качественные реакции – это реакции не собственно на белки, а на определенные аминокислоты, входящие в их состав.
Слайд 20Биуретовая реакция
Определяет наличие пептидной связи в растворе исследуемого соединения.
пептидная связь
Слайд 22Ксантопротеиновая реакция
Определяет присутствие в белке ароматических и гетероциклических α - аминокислот
триптофана,
фенилаланина,
тирозина,
гистидина.
Слайд 24Цистеиновая реакция
Определяет наличие сульфидных мостиков S-S в растворе исследуемого соединения.
NaOH
Слайд 25Закрепление изученного материала
Осуществи цепочку превращений
1. метан
2. хлорметан полипептид