- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Азотная кислота ( 9 класс)
Содержание
- 1. Презентация по химии на тему Азотная кислота ( 9 класс)
- 2. Итак, с древности (с VIII века) существовал
- 3. Смесь концентрированных азотной и соляной кислот
- 4. Слайд 4
- 5. HNO3 – азотная кислотаФизические свойства1. Молярная масса
- 6. Слайд 6
- 7. Закончите уравнения реакций, составьте для них полные
- 8. Проверим заданиеа) CaО + 2HNO3 =Сa(NO3)2 +
- 9. Окислительно-восстановительные реакции с участием HNO3 …
- 10. Окислительно-восстановительные реакции с участием HNO3 3Zn0 +
- 11. Окислительно-восстановительные реакции с участием HNO3 … Zn0
- 12. Окислительно-восстановительные реакции с участием HNO3 5Zn0 +
- 13. Окислительно-восстановительные реакции с участием HNO3 … S0
- 14. Окислительно-восстановительные реакции с участием HNO3 S0 +
- 15. Окислительно-восстановительные реакции с участием HNO3 … P0 +… HN+5O3 +… H2O =… H3P+5O4 +…N+2O
- 16. Окислительно-восстановительные реакции с участием HNO3 3P0 +5HN+5O3
- 17. Окислительно-восстановительные реакции с участием HNO3 … HN+5O3
- 18. Окислительно-восстановительные реакции с участием HNO3 4HN+5O3 =
- 19. Действие на органические веществаБелки при взаимодействии с
- 20. Слайд 20
- 21. Домашнее задание§27 Т 1-2 с. 96Составить уравнения
Слайд 2Итак, с древности (с VIII века) существовал способ получения азотной кислоты
а) селитры (NaNO3 или KNO3)
б) с квасцами (M+2SO4 * M3+2(SO4)3 * 24H2O, где где M+ — один из щелочных металлов (литий, натрий, калий, рубидий или цезий, а M3+ — один из трехвалентных металлов (обычно алюминий, хром или железо (III), например, Na2SO4 *Fe2(SO4)3 *24H2O
в) медным купоросом (CuSO4 * 5H2O).
Этот метод с теми или иными модификациями, наиболее существенной из которых была замена медного купороса железным (FeSO4 * 7H2O), применялся в европейской и арабской алхимии вплоть до XVII века,
когда немецкий химик И. Р. Глаубер предложил получать
азотную кислоту при умеренном нагревании (до 150ºC)
калиевой селитры с концентрированной серной кислотой:
KNO3 + конц. H2SO4 =HNO3 + KHSO4.
Иоганн-Рудольф
Глаубер,
1604 – 1668 г.г.
Слайд 3 Смесь концентрированных азотной и соляной кислот (соотношение по объему 1
она растворяет даже благородные металлы.
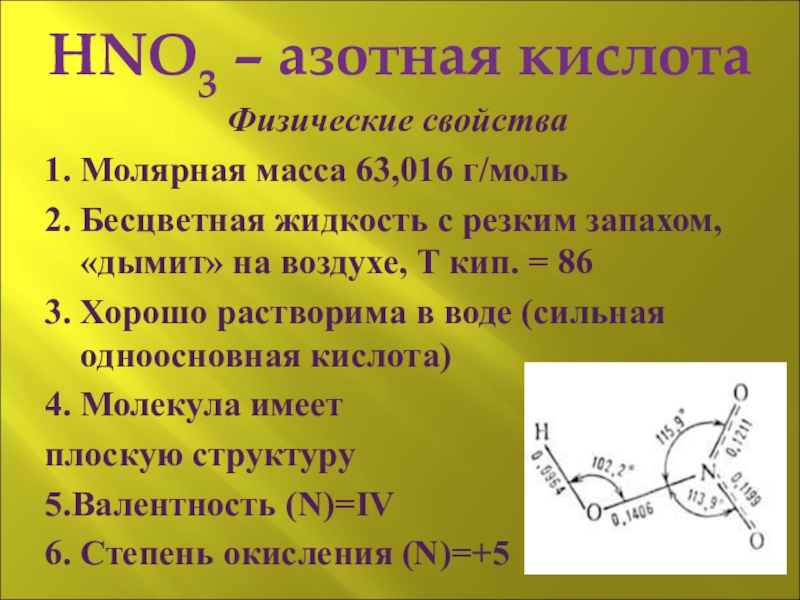
Слайд 5HNO3 – азотная кислота
Физические свойства
1. Молярная масса 63,016 г/моль
2. Бесцветная жидкость
3. Хорошо растворима в воде (сильная одноосновная кислота)
4. Молекула имеет
плоскую структуру
5.Валентность (N)=IV
6. Степень окисления (N)=+5
Слайд 7Закончите уравнения реакций,
составьте для них полные и сокращенные ионные уравнения
а)
б) CaCO3 + HNO3 =
в) Cu(OH)2 + HNO3 =
г) ZnO + HNO3 =
д) NaOH + HNO3 =
е) Na2SO3 + HNO3 =
Слайд 8Проверим задание
а) CaО + 2HNO3 =Сa(NO3)2 + H2O
CaO +
CaO + 2H+ = Ca2+ + H2O
б) CaCO3 + 2HNO3 = Сa(NO3)2 + CO2 + H2O
CaCO3 + 2H+ + 2NO3– =Ca2+ + 2 NO3– + CO2 + H2O
CaCO3 + 2H+ = Ca2+ + CO2 + H2O
в) Cu(OH)2 + 2HNO3 = Сu(NO3)2 + 2H2O
Cu(OH)2 + 2H+ + 2NO3– =Cu2+ + 2 NO3– + 2H2O
Cu(OH)2 + 2H+ = Cu2+ + 2H2O
г) ZnO + 2HNO3 = Zn(NO3)2 + H2O
ZnO + 2H+ + 2NO3– =Zn2+ + 2 NO3– + H2O
ZnO + 2H+ = Zn2+ + H2O
д) NaOH + HNO3 = NaNO3 + H2O
Na+ + OH– + H+ + NO3– =Na+ + NO3– + H2O
OH– + H+ = H2O
е) Na2SO3 + 2HNO3 = 2NaNO3 + SO2 + H2O
2Na+ + SO32 – + 2H+ + 2NO3– =2Na+ + 2NO3– + SO2 + H2O
SO32 – + 2H+ = SO2 + H2O
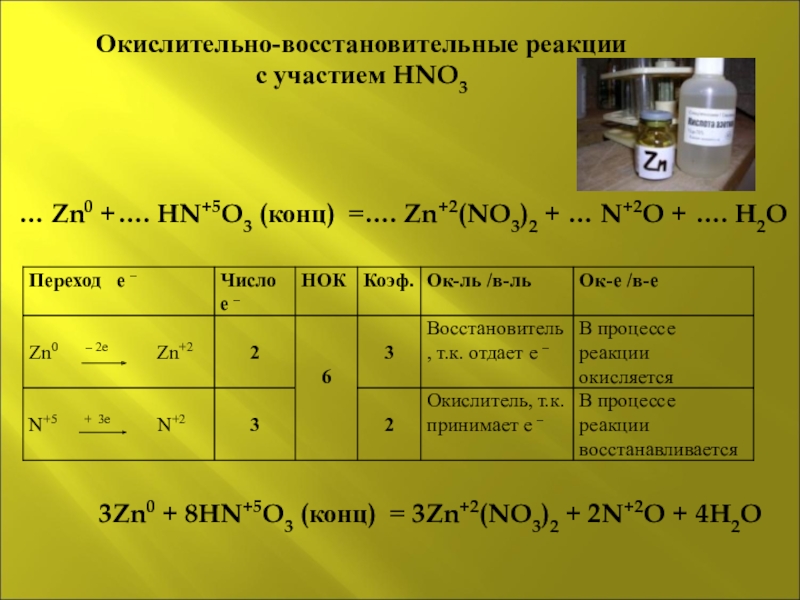
Слайд 9Окислительно-восстановительные реакции
с участием HNO3
… Zn0 +…. HN+5O3 (конц)
Слайд 10Окислительно-восстановительные реакции
с участием HNO3
3Zn0 + 8HN+5O3 (конц) = 3Zn+2(NO3)2
… Zn0 +…. HN+5O3 (конц) =…. Zn+2(NO3)2 + … N+2O + …. H2O
Слайд 11Окислительно-восстановительные реакции
с участием HNO3
… Zn0 + … HN+5O3 (разб)
Слайд 12Окислительно-восстановительные реакции
с участием HNO3
5Zn0 + 12HN+5O3 (разб) = 5Zn+2(NO3)2
… Zn0 + … HN+5O3 (разб) = … Zn+2(NO3)2 + … N20 + … H2O
Слайд 13Окислительно-восстановительные реакции
с участием HNO3
… S0 +… HN+5O3 = …
Слайд 14Окислительно-восстановительные реакции
с участием HNO3
S0 + 6HN+5O3 = H2S+6O4 +
… S0 + … HN+5O3 = … H2S+6O4 + … N+4O2 + … H2O
Слайд 15Окислительно-восстановительные реакции
с участием HNO3
… P0 +… HN+5O3 +… H2O
Слайд 16Окислительно-восстановительные реакции
с участием HNO3
3P0 +5HN+5O3 + 2H2O = 3H3P+5O4
… P0 + … HN+5O3 + … H2O = … H3P+5O4 + … N+2O
Слайд 18Окислительно-восстановительные реакции
с участием HNO3
4HN+5O3 = 4N+4O2 + 2H2O +
… HN+5O3 = … N+4O2 + … H2O + … O20
Слайд 19Действие на органические вещества
Белки при взаимодействии с конц.азотной кислотой разрушаются и
Под действием азотной кислоты воспламеняются бумага, масло, древесина, уголь.
Слайд 21Домашнее задание
§27
Т 1-2 с. 96
Составить уравнения окислительно-восстановительных
реакций с электронными
а) Cu + HNO3 (разб) =
б) Cr + HNO3 (разб) =
в) Ag + HNO3 (конц) =
г) S + HNO3 = H2SO4 + NO
д) P + HNO3 = H3PO4 + NO2 + H2O