- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Азот и Фосфор (11 клас)
Содержание
- 1. Презентация по химии на тему Азот и Фосфор (11 клас)
- 2. Азот және фосфордың ашылу
- 3. Ауада азот бар екендігі Қытайда 8 ғасырда
- 4. Фосфордың ашылуыХенниг Бранд фосфорды 1669 жылы кездейсоқ
- 5. Слайд 5
- 6. Периодтық жүйедегі орны, атом құрылысы. +15
- 7. РАДАМ АҒЗАСЫНДАМИНЕРАЛДАРФОСФОРИТБИРЮЗА АПАТИТТабиғатта таралуыАПАТИТЗат алмасуда, ақуыз, құрамына кіреді. Тіс пен сүйекте, жүйке Ұлпаларында, бұлшық еттерде болады.
- 8. NАуада – 78,09%Топырақта – 0,01 – 0,04
- 9. АЛЛОТРОПИЯЛЫҚ ТҮРӨЗГЕРІСТЕРІРАҚҚЫЗЫЛҚАРА
- 10. P4 молекуласы тетраэдр пішінді. Оңай балқиды t(б)=44,1оС,
- 11. Қызыл фосфордың бірнеше түрі белгілі.
- 12. Қара фосфордың кристалдық торы атомдық.
- 13. Химиялық қасиеттері:
- 14. Химиялық қасиеттеріЭлектронды баланс теңдеуін құрастырып , химиялық реакция теңдеулерінің коэффициенттерін қойып теңестіріңдер.
- 15. Физикалық қасиеттері Рақсарықызылкүлгін
- 16. Фосфордың алынуыФосфорит, көмір, құмды қосып, қыздырғандаCa3(PO4)2 + 5C + 3SiO2 → 2P + 3CaSiO3 + 5CO
- 17. ҚолданылуыАзотНитридалу үшінТүрлітыңайтқыштарАммиаксинтезіндеАзот қышқылынСалқындатқышжүйеИнертті ортада
- 18. ҚолданылуыРтыңайтқышУлы химикаттарСіреңке ӨндірісіндеТүтіндеткіш аспаптарЖартылай өткізгіштердеБояу өндірісіндеЖемірілуден қорғаудаЖуғыш заттар
- 19. ҚолданылуыФосфорР кемірушілермен күресте Zn3Р2 тыңайтқыштарТүтіндейтін құтыларжағатын бомбаларсіріңке
- 20. Табиғаттағы фосфорМинералдарыАпатиттер Са5(РО4)3(F, Cl, OH) Фосфор
- 21. Адам ағзасындағы фосфор «Фосфорсыз қозғалыс болмайды, себебі
Азот және фосфордың ашылу тарихыАзот және фосфордың периодтық жүйедегі орныТабиғата таралуыАллотропиялық түрөзгерістеріФизикалық және химиялық қасиеттеріАлу әдістері Қолданылуы Сабақтың барысы:
Слайд 2
Азот және фосфордың ашылу тарихы
Азот және фосфордың
периодтық жүйедегі орны
Табиғата таралуы
Аллотропиялық түрөзгерістері
Физикалық және химиялық қасиеттері
Алу әдістері
Қолданылуы
Табиғата таралуы
Аллотропиялық түрөзгерістері
Физикалық және химиялық қасиеттері
Алу әдістері
Қолданылуы
Сабақтың барысы:
Слайд 3Ауада азот бар екендігі Қытайда 8 ғасырда Мао- Хоаның жұмыстарында жазылған.
Европада азоттың ашылуы ауаның күрделі қоспа екендігін білумен қабат жүрді. Осы бағытта азотты алғаш 1772 жылы жәрдемсіз екендігін анықтап, Резерфорд оның дем алуға, жануға жәрдемсіз екендігін анықтап «улы ауа» деп атаған;
азоттың ашылу тарихы
1772 ж Д. Резерфорд
Слайд 4Фосфордың ашылуы
Хенниг Бранд фосфорды 1669 жылы кездейсоқ ашты.
Өз зерттеулерінде Бранд зәрден «күмістің кесегі алтынға айналатын» сұйықтықты дайындады.
Зәрді айдау арқылы өңдеу кезінде, алхимик таңқаларлық зат алды. Алтын емес, есесіне белгісіз өздігінен жарқырайтын зат, салқын от – фосфорус түзілді.
Зәрді айдау арқылы өңдеу кезінде, алхимик таңқаларлық зат алды. Алтын емес, есесіне белгісіз өздігінен жарқырайтын зат, салқын от – фосфорус түзілді.
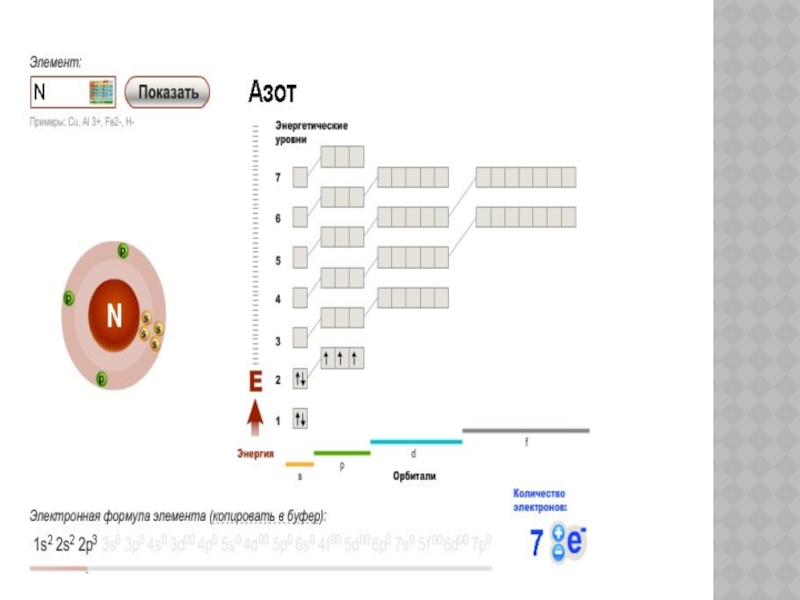
Слайд 6Периодтық жүйедегі орны,
атом құрылысы.
+15 Р
1s2
2s2
2p6
3s2
3p3
3d0
Тотығу дәрежесі:
-3, +3,
+5
+15
) )
)
2 8 5
2 8 5
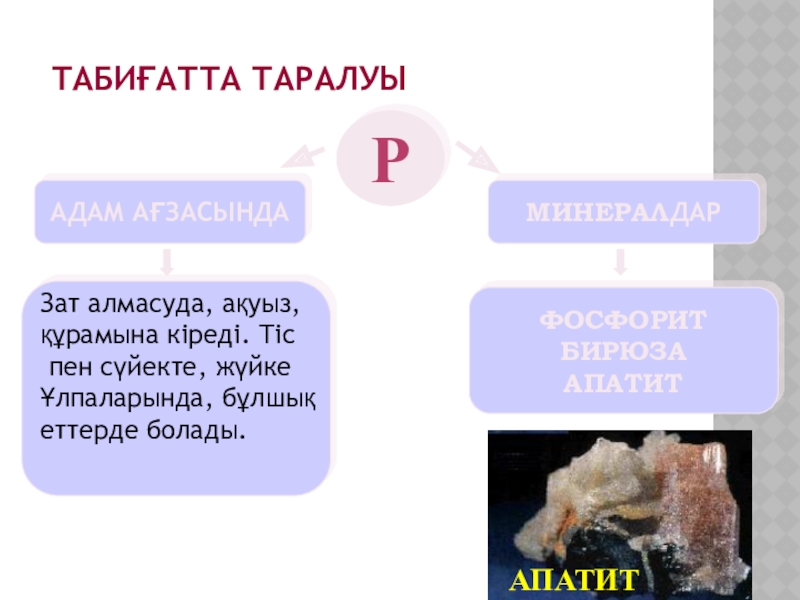
Слайд 7Р
АДАМ АҒЗАСЫНДА
МИНЕРАЛДАР
ФОСФОРИТ
БИРЮЗА
АПАТИТ
Табиғатта таралуы
АПАТИТ
Зат алмасуда, ақуыз,
құрамына кіреді. Тіс
пен сүйекте,
жүйке
Ұлпаларында, бұлшық
еттерде болады.
Ұлпаларында, бұлшық
еттерде болады.
Слайд 8N
Ауада – 78,09%
Топырақта – 0,01
– 0,04 %
Өсімдіктер
(ион түрінде)
Табиғатта таралуы
Адам
ағзасында – 3,1 %
(ақуыз, дәрумен, гармон)
(ақуыз, дәрумен, гармон)
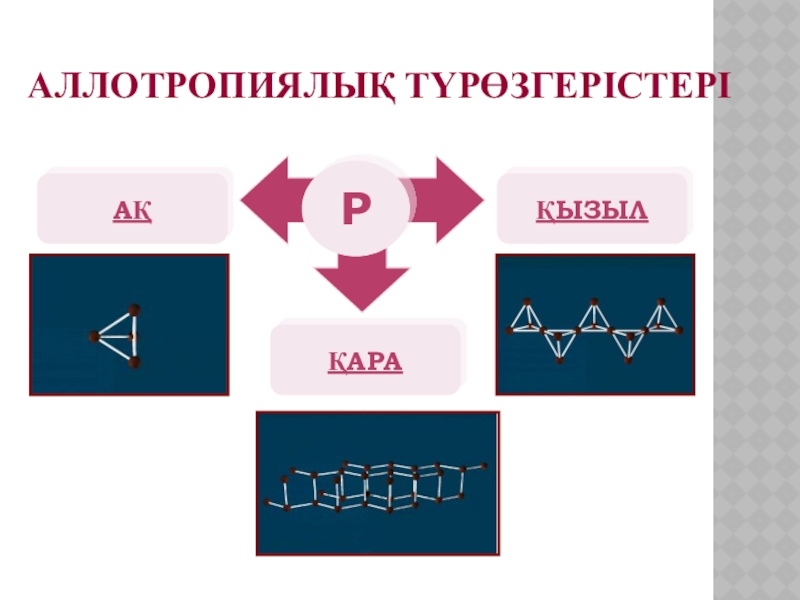
Слайд 10P4 молекуласы тетраэдр пішінді. Оңай балқиды t(б)=44,1оС, t(қайн)=275оС, жұмсақ, түссіз аморфты
зат. Тек күкірткөміртекте ғана ериді. Улы, ауада тез тұтанады, қаранғыда жарық шығарады. Су астында сақтайды.
АҚ ФОСФОР
Ақ фосфор тұрақсыз түрі.
Слайд 11 Қызыл фосфордың бірнеше түрі белгілі. Олардың құрылымы дұрыс дәлелденбеген.
Кристал торлары полимерлі атомдық заттар. Балқу температурасы
585-600оС, түсі қара қоңырдан қызыл болады. Улы емес.
585-600оС, түсі қара қоңырдан қызыл болады. Улы емес.
ҚЫЗЫЛ ФОСФОР
Слайд 12 Қара фосфордың кристалдық торы атомдық. Графитке ұқсас, жартылай өткізгіш
болып табылады. Улы емес.
Қара фосфор
Қара фосфор өте сирек кездеседі.
Слайд 14Химиялық қасиеттері
Электронды баланс теңдеуін құрастырып ,
химиялық реакция теңдеулерінің коэффициенттерін қойып
теңестіріңдер.
Слайд 16Фосфордың алынуы
Фосфорит, көмір, құмды қосып, қыздырғанда
Ca3(PO4)2 + 5C + 3SiO2 →
2P + 3CaSiO3 + 5CO
Слайд 17Қолданылуы
Азот
Нитрид
алу үшін
Түрлі
тыңайтқыштар
Аммиак
синтезінде
Азот
қышқылын
Салқындатқыш
жүйе
Инертті
ортада
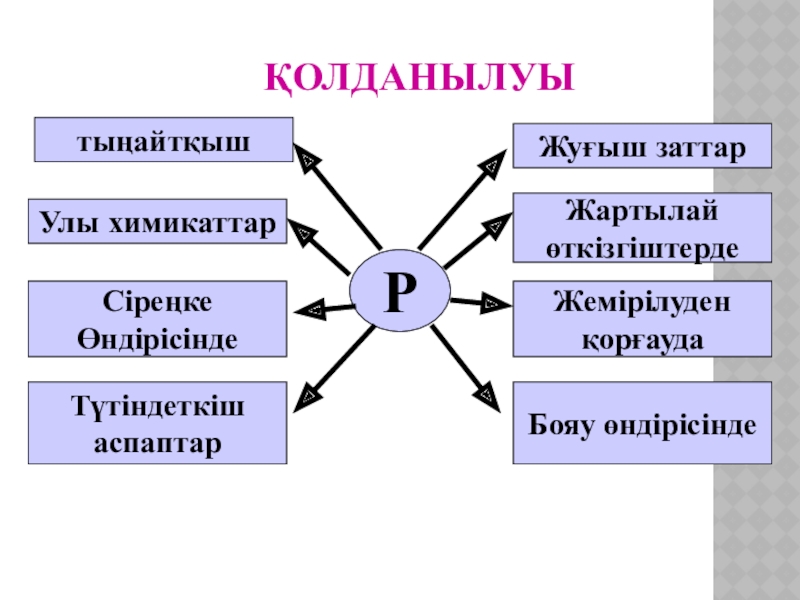
Слайд 18Қолданылуы
Р
тыңайтқыш
Улы химикаттар
Сіреңке
Өндірісінде
Түтіндеткіш
аспаптар
Жартылай
өткізгіштерде
Бояу өндірісінде
Жемірілуден
қорғауда
Жуғыш заттар
Слайд 19Қолданылуы
Фосфор
Р
кемірушілермен күресте Zn3Р2
тыңайтқыштар
Түтіндейтін құтылар
жағатын бомбалар
сіріңке
Слайд 20 Табиғаттағы фосфор
Минералдары
Апатиттер Са5(РО4)3(F, Cl, OH)
Фосфор кең таралған элемент, оның
жер қыртысындағы мөлшері шамамен 0,1%.
Слайд 21Адам ағзасындағы фосфор
«Фосфорсыз қозғалыс болмайды, себебі бұлшықеттердің жиырылу химизмі –
бұл түгелімен дерлік фосфорлы қосылыстардың химиясы".
В.А.Энгельгардт
1 – 1,5 г