- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Атомно-молекулярное учение. Относительная атомная масса (8 класс)
Содержание
- 1. Презентация по химии на тему Атомно-молекулярное учение. Относительная атомная масса (8 класс)
- 2. В начале урока самостоятельная работа
- 3. Атомно-молекулярное учение.
- 4. Теории в химии: Атомно-молекулярное учение
- 5. Атомно-молекулярное учение: В 1741 г. в книге «Элементы
- 6. Основные положения атомно-молекулярного учения : 1. Молекула —
- 7. Основные положения атомно-молекулярного учения : 1. Молекула — наименьшая часть вещества, сохраняющая его состав и важнейшие свойства.
- 8. Основные положения атомно-молекулярного учения : Молекулы состоят
- 9. Основные положения атомно-молекулярного учения : Атомы и молекулы находятся в непрерывном движении. (Броуновское движение)
- 10. Основные положения атомно-молекулярного учения : 4. При физических явлениях молекулы сохраняются, при химических — разрушаются.испарение
- 11. Основные положения атомно-молекулярного учения : 5. Атомы в
- 12. ОННОННН2Н2О2Основные положения атомно-молекулярного учения :
- 13. Относительная атомная масса.
- 14. В каких единицах измеряется масса? Как
- 15. Истинная масса атомов Истинные массы атомов очень
- 16. Атомная Единица МассыЕдиница сравнения это -Атомная Единица
- 17. Относительная атомная массаОтносительная атомная масса обозначается Аr.Аr(Н)
- 18. Задание 1. Запишите значения относительных атомных масс элементов
- 19. Потренируемся:
- 20. Слайд 20
В начале урока самостоятельная работа
Слайд 5Атомно-молекулярное учение:
В 1741 г. в книге «Элементы математической химии» М.В.Ломоносов фактически
сформулировал основы атомно-молекулярного учения.
Русский учёный-энциклопедист рассматривал строение вещества не как определённую комбинацию атомов, но как сочетание более крупных частиц —
, которые, в свою очередь, состоят из более мелких частиц —
.
Русский учёный-энциклопедист рассматривал строение вещества не как определённую комбинацию атомов, но как сочетание более крупных частиц —
, которые, в свою очередь, состоят из более мелких частиц —
.
молекул
корпускул
элементов
атомов
Слайд 6Основные положения
атомно-молекулярного учения :
1. Молекула — наименьшая часть вещества, сохраняющая его
состав и важнейшие свойства.
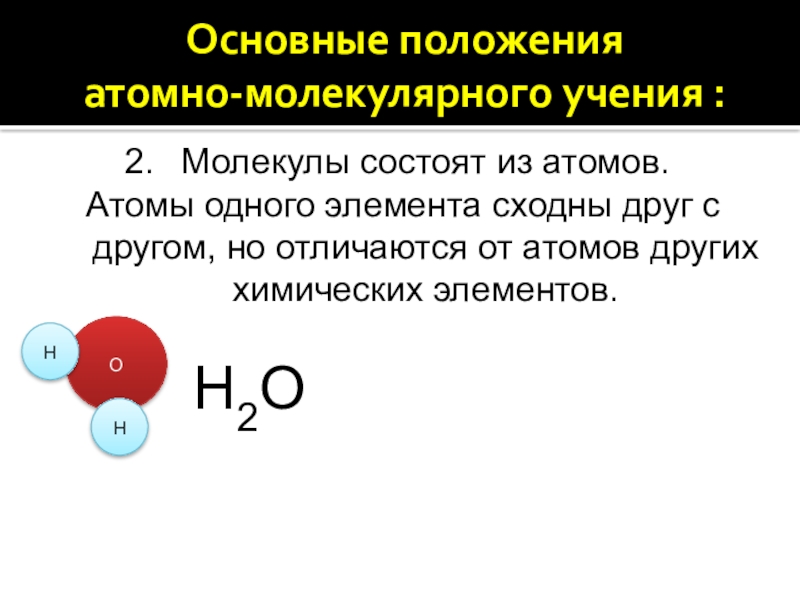
2. Молекулы состоят из атомов. Атомы одного элемента сходны друг с другом, но отличаются от атомов других химических элементов.
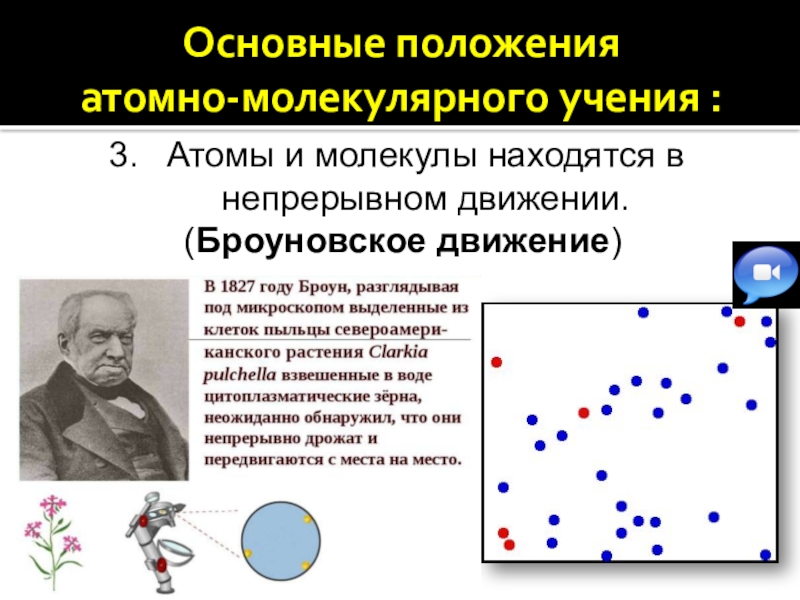
3. Атомы и молекулы находятся в непрерывном движении.
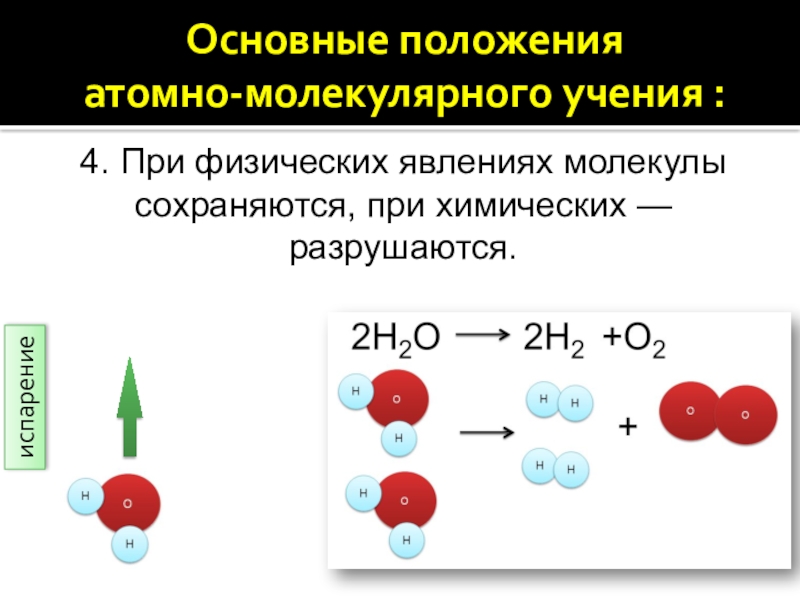
4. При физических явлениях молекулы сохраняются, при химических — разрушаются.
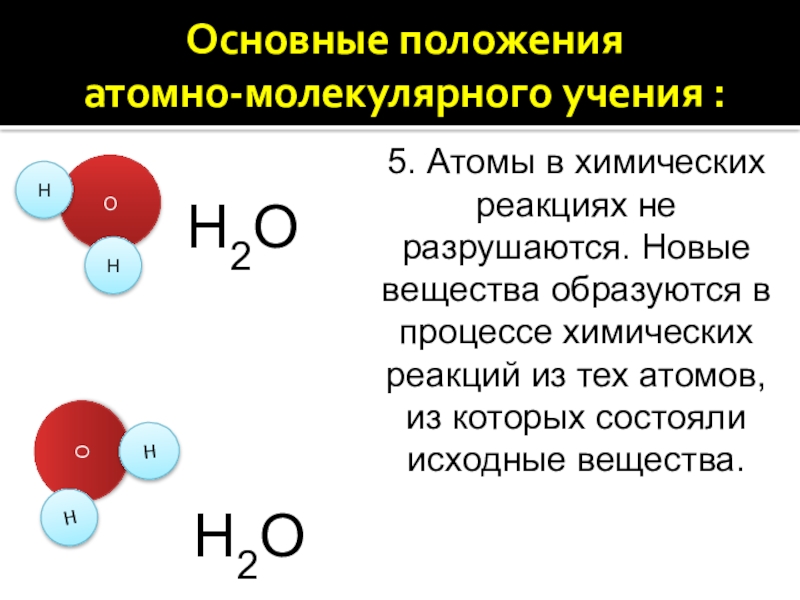
5. Атомы в химических реакциях не разрушаются. Новые вещества образуются в процессе химических реакций из тех атомов, из которых состояли исходные вещества.
2. Молекулы состоят из атомов. Атомы одного элемента сходны друг с другом, но отличаются от атомов других химических элементов.
3. Атомы и молекулы находятся в непрерывном движении.
4. При физических явлениях молекулы сохраняются, при химических — разрушаются.
5. Атомы в химических реакциях не разрушаются. Новые вещества образуются в процессе химических реакций из тех атомов, из которых состояли исходные вещества.
Слайд 7Основные положения
атомно-молекулярного учения :
1. Молекула — наименьшая часть вещества, сохраняющая его
состав и важнейшие свойства.
Слайд 8Основные положения
атомно-молекулярного учения :
Молекулы состоят из атомов.
Атомы одного элемента
сходны друг с другом, но отличаются от атомов других химических элементов.
О
Н
Н
Н2О
Слайд 9Основные положения
атомно-молекулярного учения :
Атомы и молекулы находятся в непрерывном движении.
(Броуновское движение)
Слайд 10Основные положения
атомно-молекулярного учения :
4. При физических явлениях молекулы сохраняются, при химических
— разрушаются.
испарение
Слайд 11Основные положения
атомно-молекулярного учения :
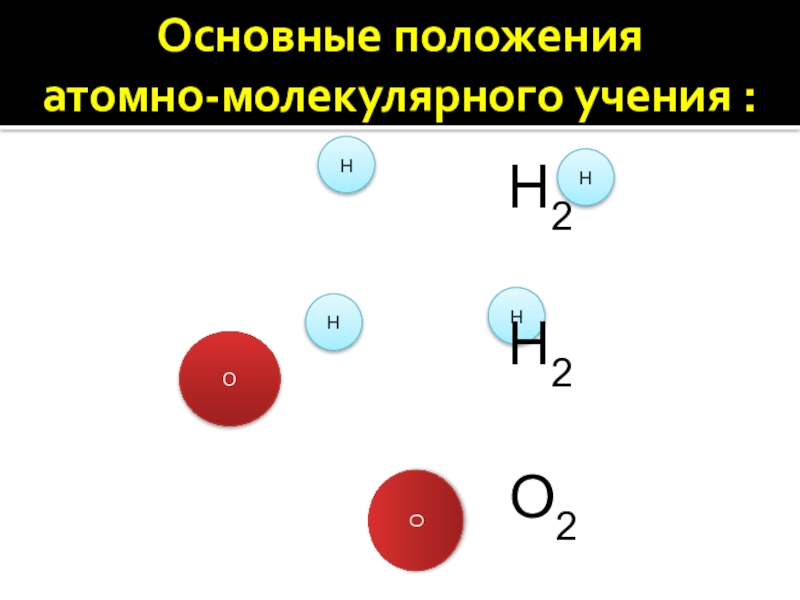
5. Атомы в химических реакциях не разрушаются. Новые
вещества образуются в процессе химических реакций из тех атомов, из которых состояли исходные вещества.
О
Н
Н
О
Н
Н
Н2О
Н2О
Слайд 14В каких единицах измеряется масса?
Как эти единицы соотносятся?
В системе СИ
(Международная система единиц) масса измеряется в килограммах.
1кг = 1000 (103) г
1мг = 0,001(10−3) г
1т = 1000 кг
1кг = 1000 (103) г
1мг = 0,001(10−3) г
1т = 1000 кг
Слайд 15Истинная масса атомов
Истинные массы атомов очень малы
масса атома водорода
– 1,66 * 10 -24 г
масса атома углерода – 2*10 -23 г
масса атома кислорода – 2,66*10 -23 г
или ma(О)=0,0000000000000000000000000266 кг
пользоваться неудобно!
масса атома углерода – 2*10 -23 г
масса атома кислорода – 2,66*10 -23 г
или ma(О)=0,0000000000000000000000000266 кг
пользоваться неудобно!
Слайд 16Атомная Единица Массы
Единица сравнения это -
Атомная Единица Массы (а.е.м.)
1а.е.м.= ma(C) / 12 = 1,99*10-23г/12= 0,166*10-23г
Таким образом а.е.м. это 1/12 массы атома углерода:
Слайд 17Относительная атомная масса
Относительная атомная масса обозначается Аr.
Аr(Н) = 1
Аr(О) = 16
Аr(С)
= 12
Аr(S) = 32
Запомните исключение:
Аr(Cl) = 35,5
Аr(S) = 32
Запомните исключение:
Аr(Cl) = 35,5