- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Атом - сложная частица (11 класс)
Содержание
- 1. Презентация по химии на тему Атом - сложная частица (11 класс)
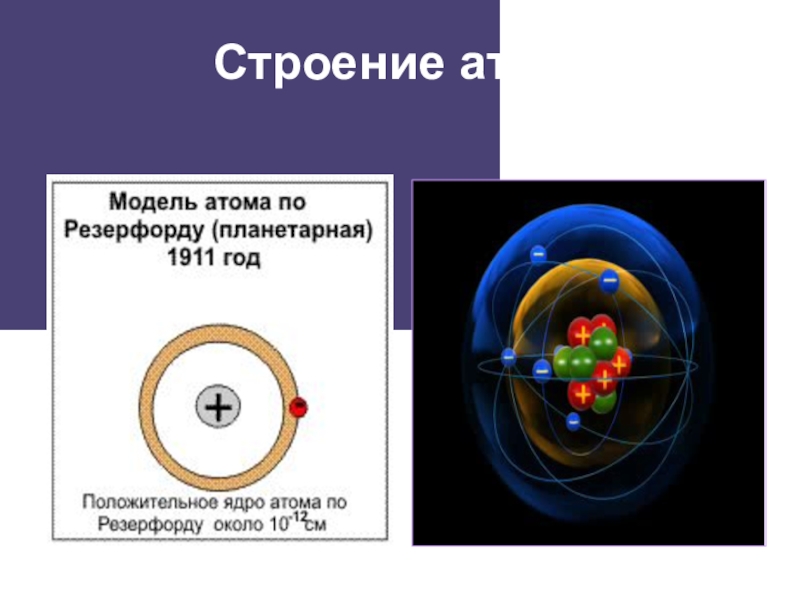
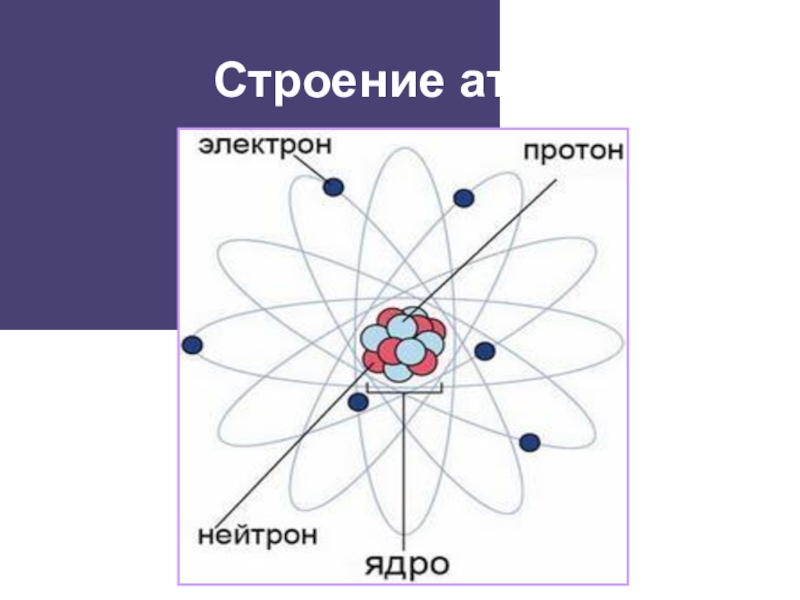
- 2. Строение атома
- 3. Строение атома
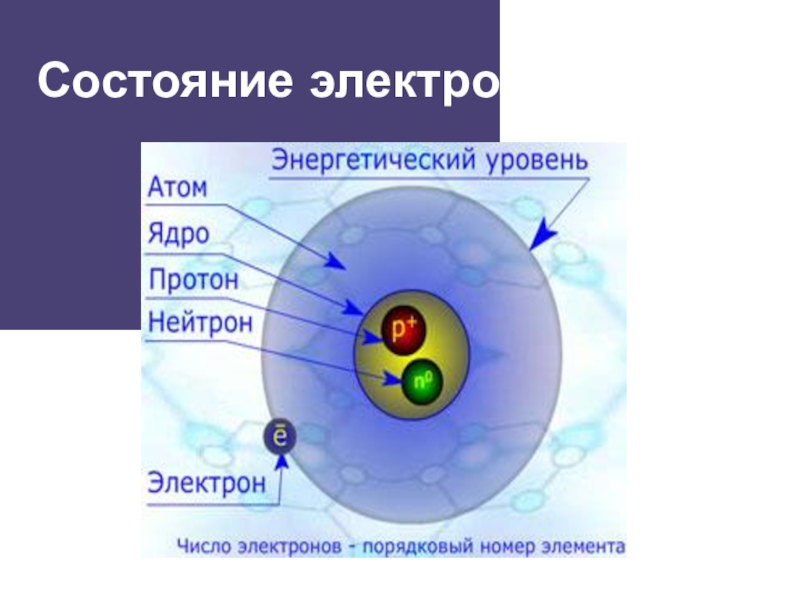
- 4. Состояние электрона в атоме
- 5. Состояние электрона в атоме Энергетические уровни
- 6. Слайд 6
- 7. Электронно-графические формулы. Число э.у. равно номеру
- 8. Распределение электронов в атоме можно описать квантовыми
- 9. Побочное (орбитальное) квантовое число l –
- 10. Магнитное квантовое число ml –
- 11. Спиновое квантовое число S (ms) -
- 12. Основные закономерности распределения электронов по орбиталям.
- 13. В атоме не может быть
- 14. При данном значении l (т.
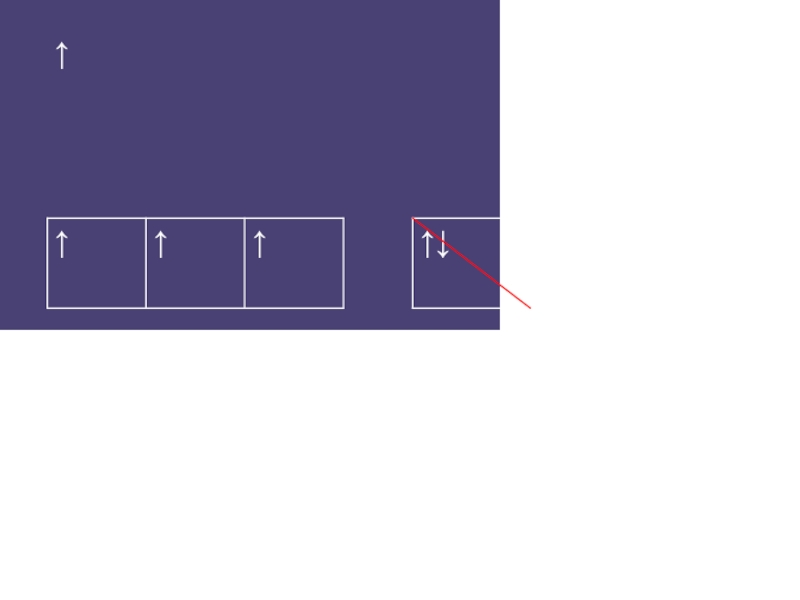
- 15. ↑
- 16. Задания:1. Может ли электрон иметь значения квантовых
Строение атома
Слайд 5Состояние электрона в атоме
Энергетические уровни состоят из подуровней. Подуровни
из орбиталей. На каждой орбитали могут находиться max 2 ē.
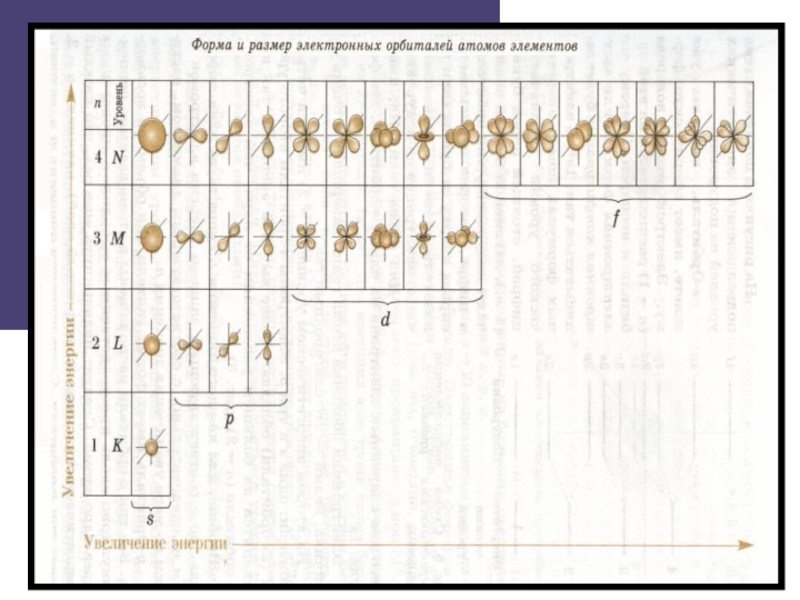
Слайд 7Электронно-графические формулы.
Число э.у. равно номеру периода, в котором находится
элемент.
На 1-ом энергетическом уровне находится одна s-орбиталь.
На 2-ом - одна s-орбиталь и три р-орбитали.
На 3-ем - одна s-орбиталь, три р-орбитали и пять d-орбиталей.
На 4-ом - одна s-орбиталь, три р-орбитали, пять d-орбиталей и семь f-орбиталей.
На 1-ом энергетическом уровне находится одна s-орбиталь.
На 2-ом - одна s-орбиталь и три р-орбитали.
На 3-ем - одна s-орбиталь, три р-орбитали и пять d-орбиталей.
На 4-ом - одна s-орбиталь, три р-орбитали, пять d-орбиталей и семь f-орбиталей.
Слайд 8Распределение электронов в атоме можно описать квантовыми числами:
Главное квантовое
число n – показывает общий запас энергии ē, а значит его удаленность от ядра.
n = 1,2…..7 и равно номеру э.у.
n = 1,2…..7 и равно номеру э.у.
Слайд 9 Побочное (орбитальное) квантовое число l – отражает разное энергетическое состояние
ē в пределах э.у., определяет форму орбитали, соответствует подуровню.
Принимает значение от 0 до 3.
Принимает значение от 0 до 3.
Слайд 10 Магнитное квантовое число ml – характеризует ориентацию орбитали в
пространстве.
Принимает значение от -l через 0 до + l.
Число значений ml равно числу орбиталей в подуровне.
Например, для р-орбиталей l=1. Тогда ml = -1, 0, +1
Принимает значение от -l через 0 до + l.
Число значений ml равно числу орбиталей в подуровне.
Например, для р-орбиталей l=1. Тогда ml = -1, 0, +1
Слайд 11 Спиновое квантовое число S (ms) - показывает направление движение ē
вокруг собственной оси.
Значения: -1/2 или +1/2.
Значения: -1/2 или +1/2.
Слайд 12Основные закономерности распределения электронов по орбиталям.
В атоме электрон занимает
орбиталь с наименьшим значением n+l.
Если эта энергия одинаковая для нескольких подуровней, ē займет подуровень с наименьшим значением n.
Если эта энергия одинаковая для нескольких подуровней, ē займет подуровень с наименьшим значением n.
Клечковский
Всеволод Маврикиевич
(1900 -1972)
Россия
Слайд 13 В атоме не может быть двух электронов, у которых
все четыре квантовых числа были бы одинаковы.
Вольфганг Эрнст Паули
(1900 – 1958)
Австрия
Слайд 14 При данном значении l (т. е. в пределах определенного
подуровня) электроны располагаются таким образам, чтобы суммарный спин был максимальным.
Фридрих Хунд
(1896 – 1997)
Германия
Слайд 16Задания:
1. Может ли электрон иметь значения квантовых чисел n=2 l=3 ml=0
s= -1/2?
Ответ обоснуйте.
2. Какие орбитали не могут существовать: 1s 3d 2f 4d 5f 2p?
Ответ обоснуйте.
2. Какие орбитали не могут существовать: 1s 3d 2f 4d 5f 2p?