- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Аммиак
Содержание
- 1. Презентация по химии на тему Аммиак
- 2. Строение атома азотаNАзот14,00672572s22p3N7N II период
- 3. Образование молекулы аммиакаПри образовании связей в молекуле
- 4. Содержание Строение атома азота. Образование молекулы аммиака.Строение
- 5. Строение молекул аммиакаМежду молекулами аммиака образуются водородные
- 6. Физические свойства аммиака Бесцветный газ с резким
- 7. Способы получения аммиакаВ промышленности: N2 +
- 8. Химические свойства аммиакаNH3 – низшая степень окисления
- 9. II. Основные свойства аммиака: При растворении аммиака
- 10. Образование иона аммонияNH3 + H+ = NH4+Н::НН::НNN:Н:+
- 11. Соли аммонияИон аммония по размерам и заряду
- 12. Разложение солей аммония при нагревании Соли летучих
- 13. Азотная кислотаАммиачнаяселитра Ca(NO3)2Сульфат аммония (NH4)2SO4Хлорид аммония NH4ClКарбамид
- 14. Благодарю за внимание Интернет ресурсы1. Энциклопедия “Кругосвет”:
Слайд 1Аммиак
NH3
Выполнила : ученица 8 «А» класса
МБОУСОШ №51
Чистикова Дарья
Руководитель:
Добрякова М.В.
Слайд 2Строение атома азота
N
Азот
14,0067
2
5
7
2s22p3
N
7N II период
V группа
2s
2p
На
на которой находятся два спаренных электрона,
и три p-орбитали, на каждой из которых по одному
неспаренному электрону.
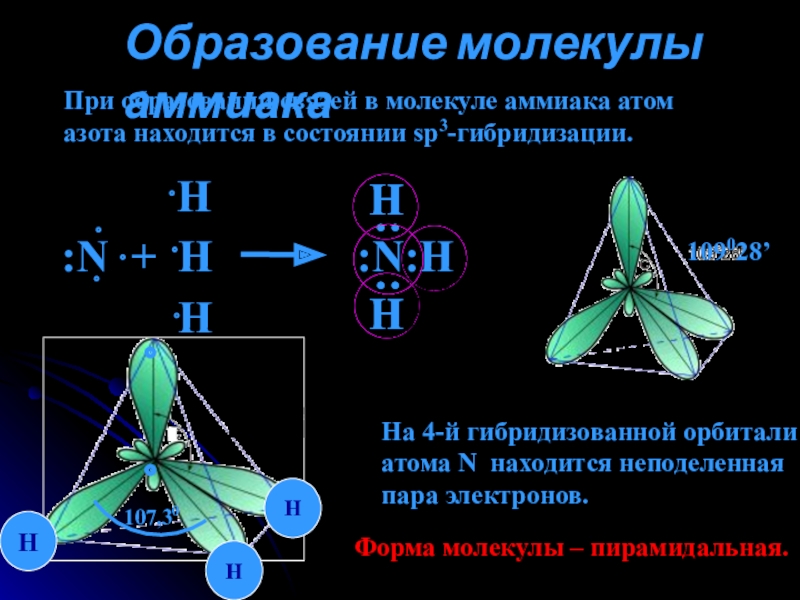
Слайд 3Образование молекулы аммиака
При образовании связей в молекуле аммиака атом
азота находится в
109028’
:N + H :N:Н
Н
Н
Н
:
:
Н
⋅
⋅
⋅
⋅
⋅
⋅
Н
Н
Н
107,30
⋅⋅
На 4-й гибридизованной орбитали
атома N находится неподеленная
пара электронов.
Форма молекулы – пирамидальная.
Н
:
:
Н
Слайд 4Содержание
Строение атома азота.
Образование молекулы аммиака.
Строение молекулы аммиака.
Физические свойства.
Химические свойства аммиака.
Образование иона аммония.
Свойства солей аммония.
Разложение солей аммония при нагревании.
Применение аммиака и солей аммония.
Слайд 5Строение молекул аммиака
Между молекулами аммиака образуются водородные связи:
Связи N-H полярные, молекула
атома азота. Одна из вершин занята неподеленной парой электронов. Молекула сильно полярна.
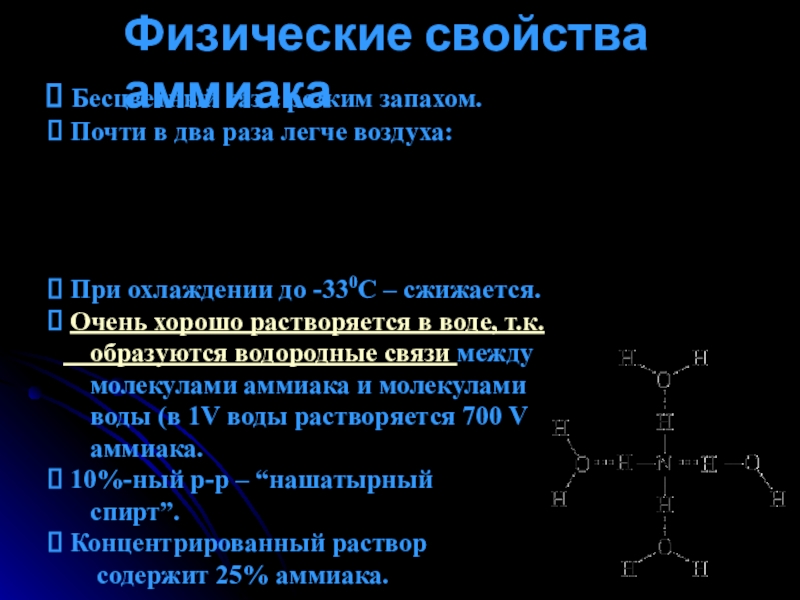
Слайд 6Физические свойства аммиака
Бесцветный газ с резким запахом.
Почти в два
При охлаждении до -330С – cжижается.
Очень хорошо растворяется в воде, т.к.
образуются водородные связи между
молекулами аммиака и молекулами
воды (в 1V воды растворяется 700 V
аммиака.
10%-ный р-р – “нашатырный
спирт”.
Концентрированный раствор
содержит 25% аммиака.
Слайд 7Способы получения аммиака
В промышленности:
N2 + 3H2
Реакция проводится при нагревании, под давлением,
в присутствии катализатора.
В лаборатории:
Действием щелочей на соли аммония:
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + 2H2O
Гидролиз нитридов:
Mg3N2 + 6H2O = 3Mg(OH)2 + 2NH3↑
Слайд 8Химические свойства аммиака
NH3 – низшая степень окисления азота.
-3
1. Аммиак - восстановитель
4NH3 + 3O2 = 2N2 + 6H2O
Каталитическое окисление аммиака:
4NH3 + 5O2 = 4NO + 6H2O
Аммиаком можно восстановить некоторые
неактивные металлы:
3CuO + 2 NH3 = 3Cu + N2 + 3H2O
Слайд 9
II. Основные свойства аммиака:
При растворении аммиака в воде образуется
NH3 + H2O NH3H2OO NH4+ + OH-
ион аммония
Изменяет окраску индикаторов:
Фенолфталеин – б/цв → малиновый
Метилоранж – оранжевый → желтый
Лакмус – фиолетовый → синий
С кислотами образует соли аммония:
NH3 + HCl = NH4Cl хлорид аммония
2NH3 + = (NH4)2SO44 сульфат аммония
NH3 + H2SO4 = NH4HSO4 гидросульфат аммония
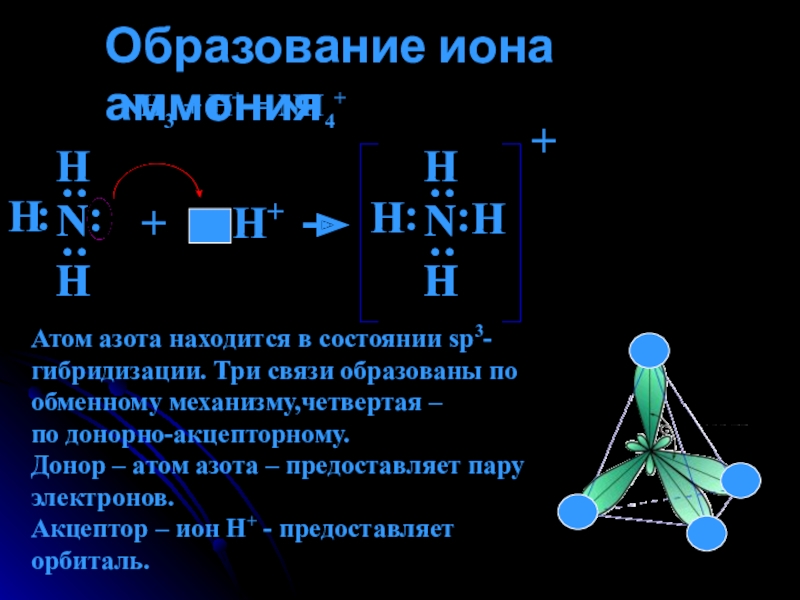
Слайд 10Образование иона аммония
NH3 + H+ = NH4+
Н
:
:
Н
Н
:
:
Н
N
N
:
Н
:
+ H+
Н
:
:
Н
Н
:
:
N
N
:
Н
:
+
Атом азота находится в состоянии sp3-гибридизации. Три связи образованы по обменному механизму,четвертая –
по донорно-акцепторному.
Донор – атом азота – предоставляет пару электронов.
Акцептор – ион Н+ - предоставляет
орбиталь.
Слайд 11Соли аммония
Ион аммония по размерам и заряду близок к
ионам щелочных металлов,
аммония похожи на соли щелочных металлов.
Кристаллические вещества.
Белого цвета.
Хорошо растворяются в воде. Их растворение
в воде сопровождается поглощением тепла.
Качественная реакция на ион аммония –
взаимодействие солей с растворами щелочей:
NH4NO3 + NaOH = NaNO3 + NH3↑ + H2O
характерный резкий
запах аммиака
Слайд 12Разложение солей аммония при нагревании
Соли летучих кислот:
NH4ClCl =
(NH4)2CO3 = 2NH3 + CO2 + H2O
Cоли нелетучих кислот:
(NH4)2SO4 = NH4HSO4 + NH3↑
(NH4)3PO4 = (NH4)2HPO4 + NH3↑ без нагревания
(NH4)2HPO4 = NH4H2PO4 + NH3↑ при нагревании
Соли с анионом-окислителем:
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
NH4NO3 = N2O + 2H2O
NH4NO2 = N2 + 2H2O
Слайд 13
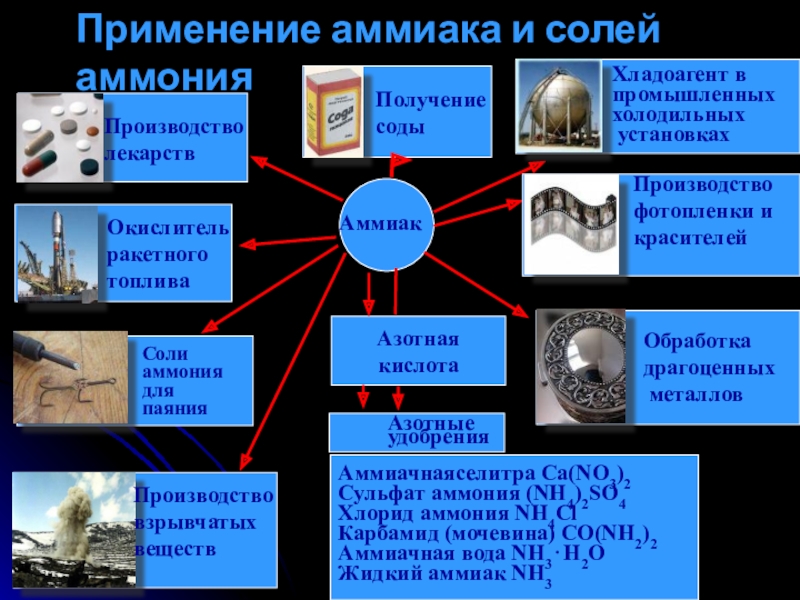
Азотная кислота
Аммиачнаяселитра Ca(NO3)2
Сульфат аммония (NH4)2SO4
Хлорид аммония NH4Cl
Карбамид (мочевина) CO(NH2)2
Аммиачная вода NH3⋅H2O
Жидкий
Аммиак
Азотные
удобрения
Производство
лекарств
Окислитель
ракетного
топлива
Соли
аммония
для
паяния
Производство
взрывчатых
веществ
Получение
соды
Хладоагент в
промышленных
холодильных
установках
Производство
фотопленки и
красителей
Обработка
драгоценных
металлов
Применение аммиака и солей аммония
Слайд 14Благодарю за внимание
Интернет ресурсы
1. Энциклопедия “Кругосвет”: химия Интернет ресурсы
http://www.krugosvet.ru/cMenu/23_00.htm
2. Популярная
3. Ни дня без химии: календарь-справочник по химической безопасности http://www.seu.ru/cci/lib/books/calendar/
4. Азбука Веб-поиска для химиков http://www.chemistry.bsu.by/abc/
5. Обучающая энциклопедия: химия http://www.informika.ru/text/database/chemy/START.html
6. Бесплатный курс химии http://www.anriintern.com/chemistry/intro.shtml
7. Справочник по химии для школьников и студентов http://www.schoolchemistry.by.ru/
8. Алхимик: сайт по химии http://alhimik.ru/index.htm