- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Аммиак
Содержание
- 1. Презентация по химии на тему Аммиак
- 2. Среди соединений азота есть удивительное вещество –
- 3. Аммиак : строение молекулы, получение, свойства, применение
- 4. История открытия аммиака Посредине ливийской пустыни стоял
- 5. За полторы тысячи лет до нашей эры
- 6. Строение молекулы аммиака+7N ) )
- 7. Физические свойства аммиакаМолекулярная кристаллическая решеткаЛегче воздухаХорошо растворим в воде1V H2O – 700V NH3
- 8. Физические свойства аммиака. Аммиак –это газ, бесцветный,
- 9. Осторожно !!!Смесь аммиака с воздухом взрывоопасна!Жидкий аммиак вызывает сильные ожоги кожи !NH3 - ЯДОВИТ!
- 10. ОТКРЫТИЕ АММИАКАЭто название предложил в 1808 г.
- 11. Получение аммиака (NH3)В лаборатории NH4Cl + Ca(OH)2
- 12. Получение в лабораторииNH4ClCa(OH)2NH3
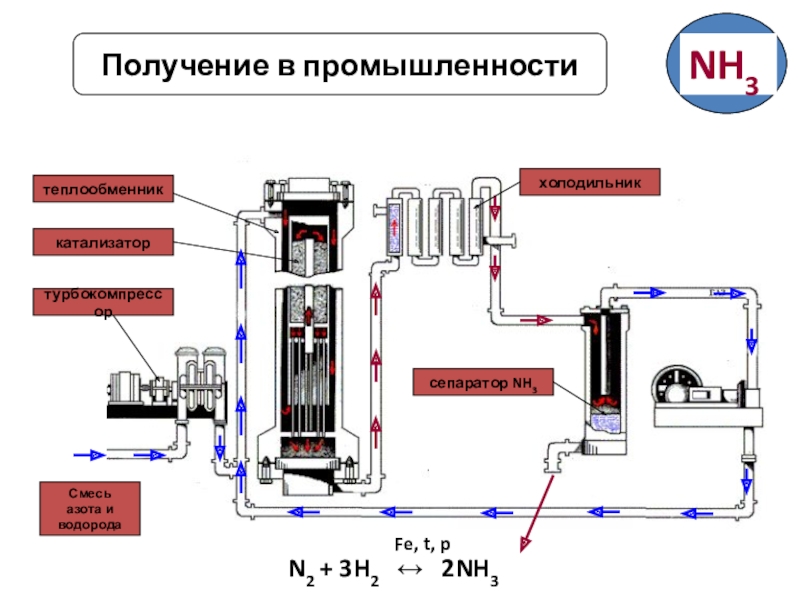
- 13. Получение в промышленностиСмесь азота и водородатурбокомпрессоркатализатортеплообменникхолодильниксепаратор NH3
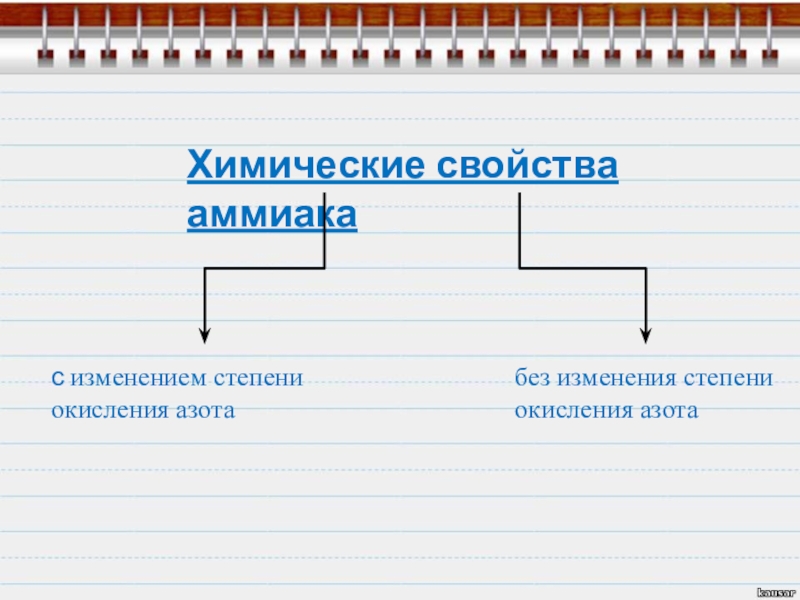
- 14. Химические свойства аммиакас изменением степени окисления азотабез изменения степени окисления азота
- 15. 3. Окисление в присутствии катализатора 1.Аммиак реагирует
- 16. ПрименениеМедицинаМоющие средстваПродукт белкового обмена в живых организмах
- 17. Слайд 17
- 18. ДОМАШНЕЕ ЗАДАНИЕ§17Упр.7 стр.52
Слайд 1Это интересно…
История произошла во время I мировой войны. Английский крейсер вел
Слайд 2Среди соединений азота есть удивительное вещество – летучее водородное соединение –
В свободном состоянии он нигде не встречается, образует соли, в которых выступает в роли щелочного металла. У всех в домашних аптечках обязательно есть его водный раствор – нашатырный спирт.
Слайд 4История открытия аммиака
Посредине ливийской пустыни стоял храм, посвященный богу Амон
Слайд 5За полторы тысячи лет до нашей эры «египетские жрецы» уже умели
Позднее это слово превратилось в нашатырь- так называли алхимики хлорид аммония.
Он применяется в медицине в качестве мочегонного средства . Но почему спирт? Ведь гидроксид аммония ничего общего со спиртами не имеет. Слово «спирт» химики заимствовали из английского языка.
Английское слово «spirit» восходит к латинскому «spiritus», что значит – душа, дух. Еще алхимики, не зная природы того или иного вещества, но отдавая ему предпочтение, называли его спиртом. Винный спирт означает «душа вина». Очевидно, неизвестный химик, растворивший в воде аммиак, полученный из нашатыря, назвал остро пахнущую жидкость «душой нашатыря», т.е. нашатырным спиртом.
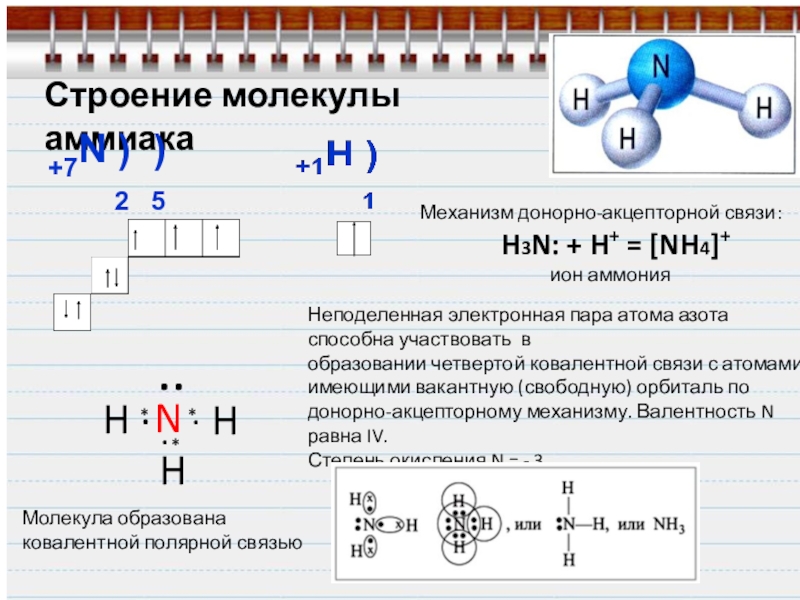
Слайд 6Строение молекулы аммиака
+7N ) )
2 5
H
N
H
H
..
Молекула
ковалентной полярной связью
Механизм донорно-акцепторной связи:
H3N: + H+ = [NH4]+
ион аммония
Неподеленная электронная пара атома азота способна участвовать в
образовании четвертой ковалентной связи с атомами, имеющими вакантную (свободную) орбиталь по донорно-акцепторному механизму. Валентность N равна IV.
Степень окисления N = - 3
*
*
*
.
.
.
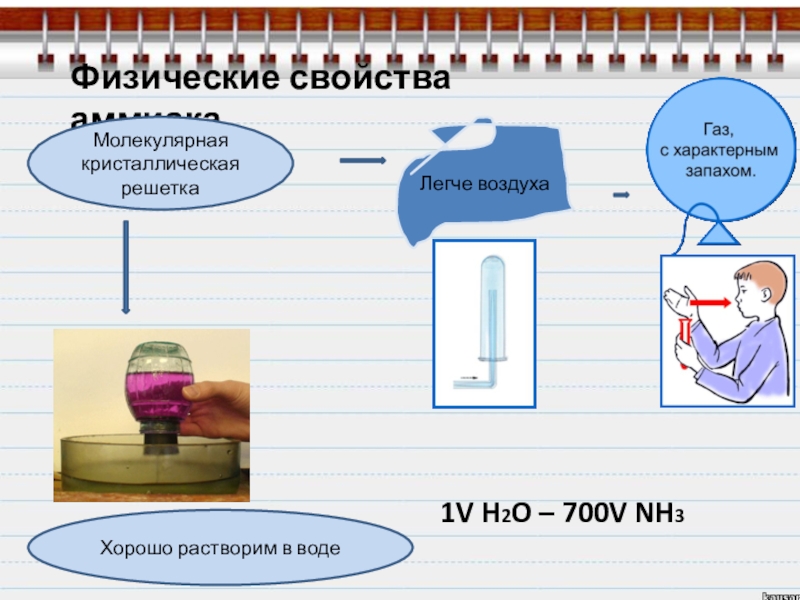
Слайд 7Физические свойства аммиака
Молекулярная
кристаллическая
решетка
Легче воздуха
Хорошо растворим в воде
1V H2O –
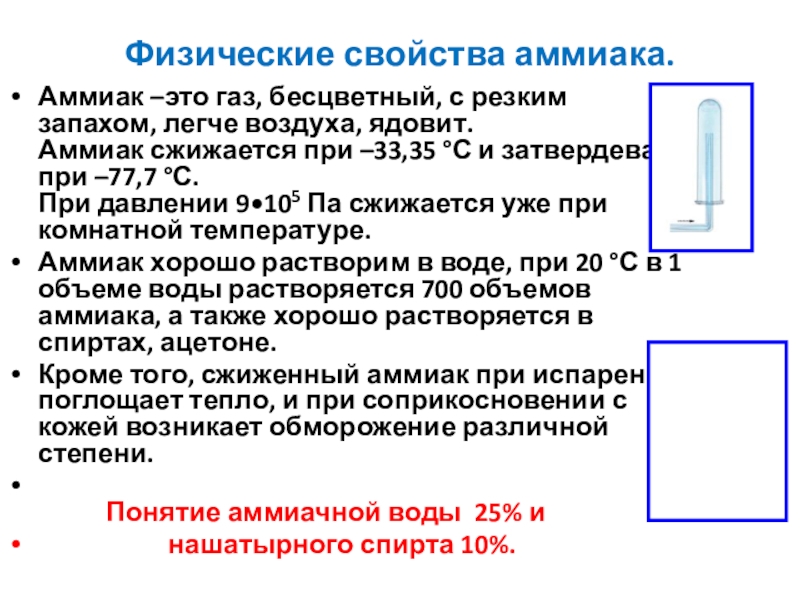
Слайд 8Физические свойства аммиака.
Аммиак –это газ, бесцветный, с резким запахом, легче воздуха,
Аммиак хорошо растворим в воде, при 20 °С в 1 объеме воды растворяется 700 объемов аммиака, а также хорошо растворяется в спиртах, ацетоне.
Кроме того, сжиженный аммиак при испарении поглощает тепло, и при соприкосновении с кожей возникает обморожение различной степени.
Понятие аммиачной воды 25% и
нашатырного спирта 10%.
Слайд 9Осторожно !!!
Смесь аммиака с воздухом взрывоопасна!
Жидкий аммиак вызывает
сильные ожоги кожи
NH3 - ЯДОВИТ!
Слайд 10ОТКРЫТИЕ АММИАКА
Это название предложил в 1808 г. знаменитый английский химик Г.Дэви.
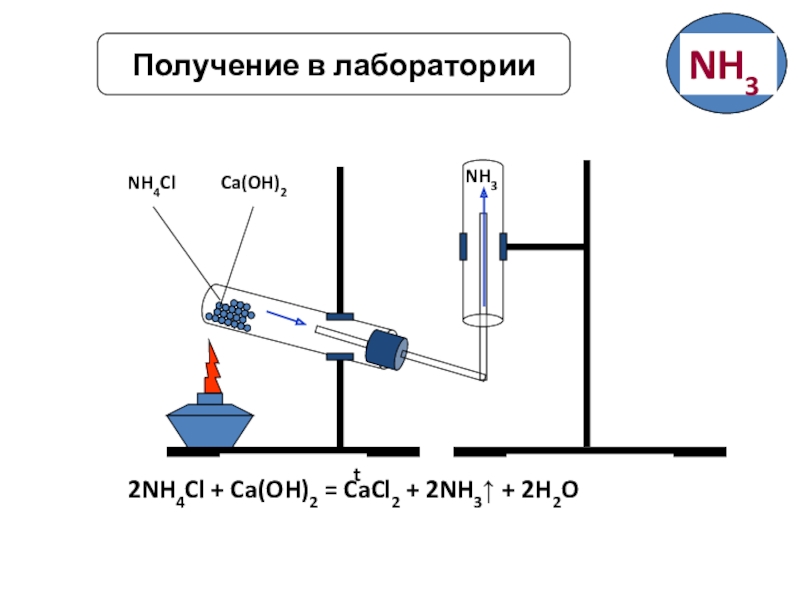
Слайд 11Получение аммиака (NH3)
В лаборатории
NH4Cl + Ca(OH)2 CaCl2+
аммиак
В промышленности
N2+ 3H2 2NH3+ Q
t
t,p
fe
В 18 веке аммиак был
получен английским химиком
Джозефом Пристли.
Слайд 13Получение в промышленности
Смесь
азота и
водорода
турбокомпрессор
катализатор
теплообменник
холодильник
сепаратор NH3
Слайд 14Химические свойства аммиака
с изменением степени
окисления азота
без изменения степени
окисления азота
Слайд 153. Окисление в присутствии
катализатора
1.Аммиак реагирует с водой
NH3 + H2O
3. Водный раствор аммиака реагирует с солями:
ZnSO4 +NH4OH →Zn(OH)2 + (NH4)2SO4