- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Аммиак
Содержание
- 1. Презентация по химии на тему Аммиак
- 2. Химическое cоединение азота и водорода с формулой
- 3. Молекула аммиака имеет форму пирамиды, в вершине которой
- 4. Аммиак («аммониак») получил своё название от древнеегипетского
- 5. История открытия аммиака Аммиак был впервые выделен
- 6. Физические свойства1.Бесцветный газ с резким неприятным запахом.
- 7. Разбавленные растворы металлов в жидком аммиаке окрашены
- 8. Получение аммиакаВ лаборатории аммиак обычно получают, нагревая
- 9. 1. Восстановительные свойства.Степень окисления азота в составе аммиака
- 10. Химические свойстваРеакции с изменением степени окисления атома
- 11. NH3+HCl=NH4Cl
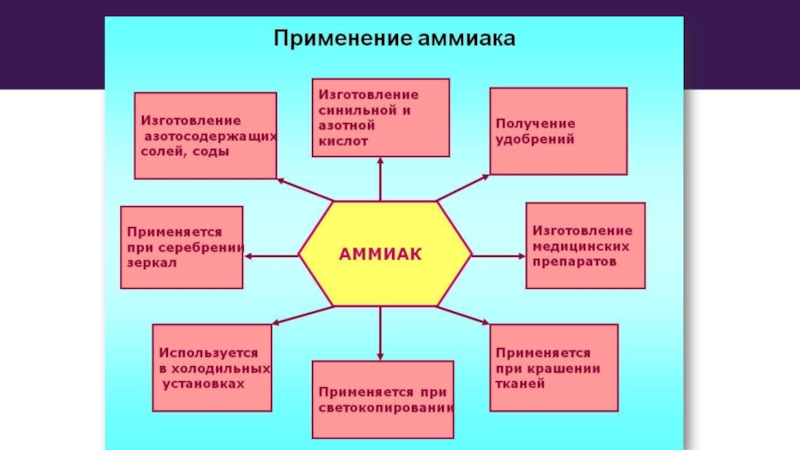
- 12. Слайд 12
- 13. Интересные факты1. Пары нашатырного спирта способны изменять окраску цветов.
- 14. СПАСИБО ЗА ВНИМАНИЕ!
Слайд 2Химическое cоединение азота и водорода с формулой NH₃, при нормальных условиях
вдвое меньше, чем у воздуха.
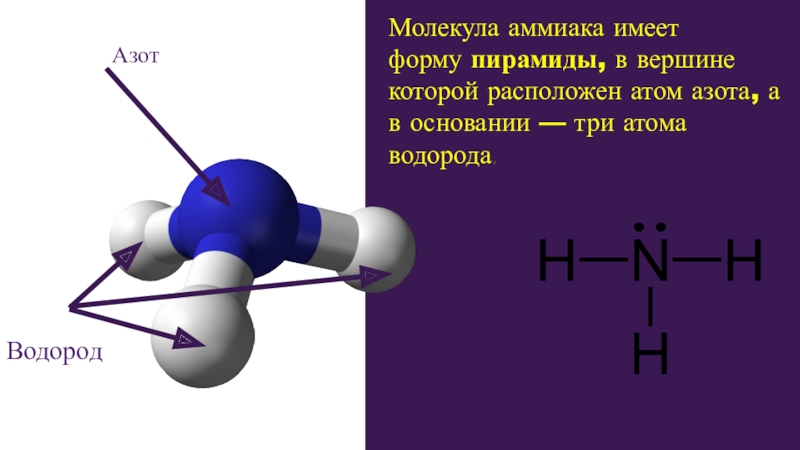
Слайд 3Молекула аммиака имеет форму пирамиды, в вершине которой расположен атом азота, а
Азот
Водород
Слайд 4Аммиак («аммониак») получил своё название от древнеегипетского слова амониан. Так называли людей,
нюхали минерал нашатырь (NH4Cl),
который при нагревании испаряет аммиак.
Слайд 5История открытия аммиака
Аммиак был впервые выделен в чистом виде Дж. Пристли в 1774
Колонна синтеза аммиака, построенная в 1921 году
Слайд 6Физические
свойства
1.Бесцветный газ с резким неприятным запахом. Он легче воздуха. Ядовит.
2.
3. Связи между атомами в молекуле аммиака – ковалентные.
4. Аммиак сжижается при температуре -33°С и становится твёрдым при -78°С.Жидкий аммиак растворяет неорганические и органические вещества, но не проводит электрический ток.
5. При испарении жидкого аммиака поглощается много тепла, что позволяет использовать его в холодильных установках.
Слайд 7Разбавленные растворы металлов в жидком аммиаке окрашены в синий цвет, концентрированные
эти комплексы разлагаются на металл и NH3.
Интересный факт:
Физические
свойства
Слайд 8Получение аммиака
В лаборатории аммиак обычно получают, нагревая хлорид аммония с гашеной
2NH4Cl + Ca(OH)2 = CaCl2 + 2H2O + 2NH3↑.
Выделяющийся аммиак содержит пары воды. Для осушения его пропускают через натронную известь (смесь извести с едким натром).
Слайд 91. Восстановительные свойства.
Степень окисления азота в составе аммиака – -3, водорода –
Химические
свойства
2. Основные свойства.
Слайд 10Химические
свойства
Реакции с изменением степени окисления атома азота (реакции окисления)
N-3 → N0 →
с кислородом
1. Горение аммиака (при нагревании)
4NH3 + 3O2 → 2N2 + 6H20
2. Каталитическое окисление амииака (катализатор Pt – Rh, температура)
4NH3 + 5O2 → 4NO + 6H2O
3.с оксидами металлов
2 NH3 + 3CuO = 3Cu + N2 + 3 H2O
4. с сильными окислителями
2NH3 + 3Cl2 = N2 + 6HCl (при нагревании)
5.аммиак – непрочное соединение, при нагревании разлагается
2NH3↔ N2 + 3H2
6. С кислотами
NH3+HCl →NH4Cl
2NH3+H2SO4 → (NH4)2SO4
7. С водой
NH3+H2O=NH4OH
Слайд 13Интересные факты
1. Пары нашатырного спирта способны изменять окраску цветов. Например, голубые и синие
2.Облака Юпитера состоят из аммиака.
3.Некоторые цветы, не имеющие запаха от природы, после обработки аммиаком начинают благоухать. Например, приятный аромат приобретают астры.
4.Нашатырный спирт реагирует с йодом с образованием крайне нестабильного иодистого азота в сухом кристаллическом
состоянии, что используется как эффектный химический опыт.