- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Аллотропия химических веществ
Содержание
- 1. Презентация по химии на тему Аллотропия химических веществ
- 2. ЦЕЛИ:СФОРМИРОВАТЬ ПОНЯТИЕ ОБ АЛЛОТРОПИИРАССМОТРЕТЬ ПРИЧИНЫ АЛЛОТРОПИИ НА
- 3. Слово «аллотропия»- происходит от греческого «аллос»-другой и
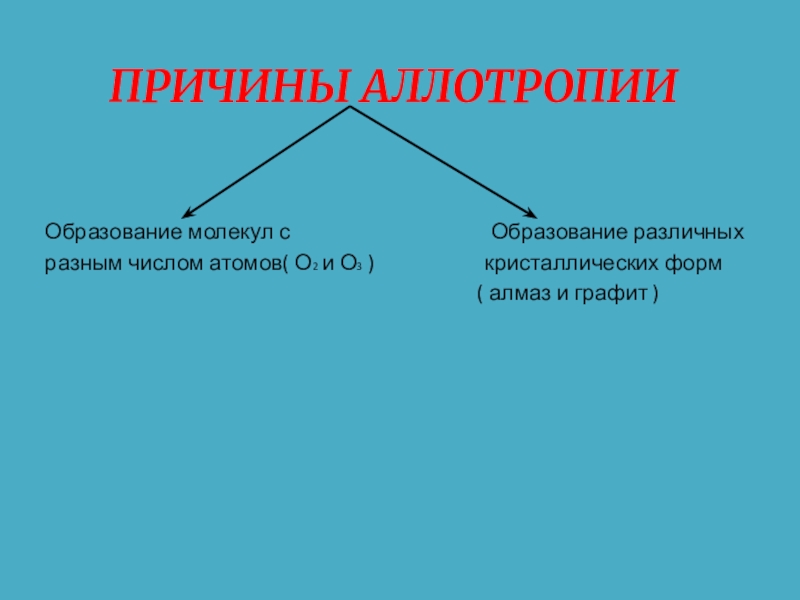
- 4. В ЧЁМ ПРИЧИНА АЛЛОТРОПИИ?
- 5. ПРИЧИНЫ АЛЛОТРОПИИОбразование
- 6. 1. Элемент кислород находится в VI группе,
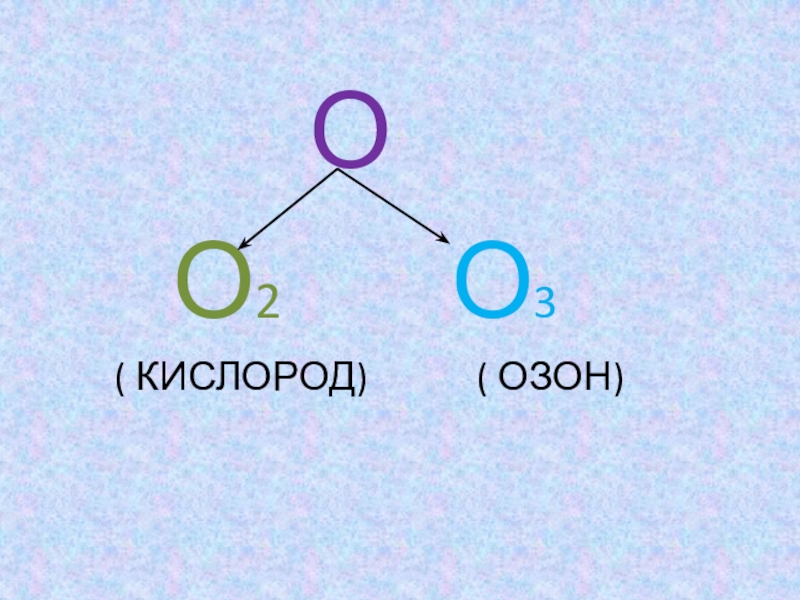
- 7. КАКИЕ АЛЛОТРОПНЫЕ МОДИФИКАЦИИ ОБРАЗУЕТ КИСЛОРОД?
- 8. Слайд 8
- 9. Физические свойства О2Расворимость-0,031 м3 в 1 м3
- 10. Слайд 10
- 11. Аллотропная модификация кислорода – озон О3 Неустойчив:
- 12. Под воздействием солнечного излучения или электрического разряда
- 13. Озон в природеСодержание озона в воздухе:Летом- до
- 14. Слайд 14
- 15. КАКИЕ АЛЛОТРОПНЫЕ МОДИФИКАЦИИ ОБРАЗУЕТ УГЛЕРОД?
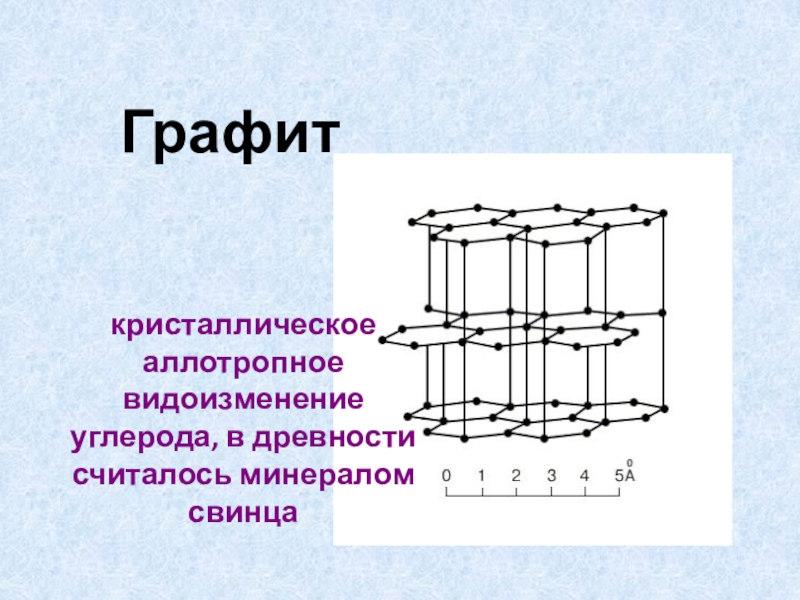
- 16. Графиткристаллическое аллотропное видоизменение углерода, в древности считалось минералом свинца
- 17. АЛМАЗ (греч. «адамас» – твёрдый, непреклонный )как аллотропное видоизменение углерода
- 18. КАРБИН
- 19. Фуллерены – молекулярная форма углеродаНазваны по имени
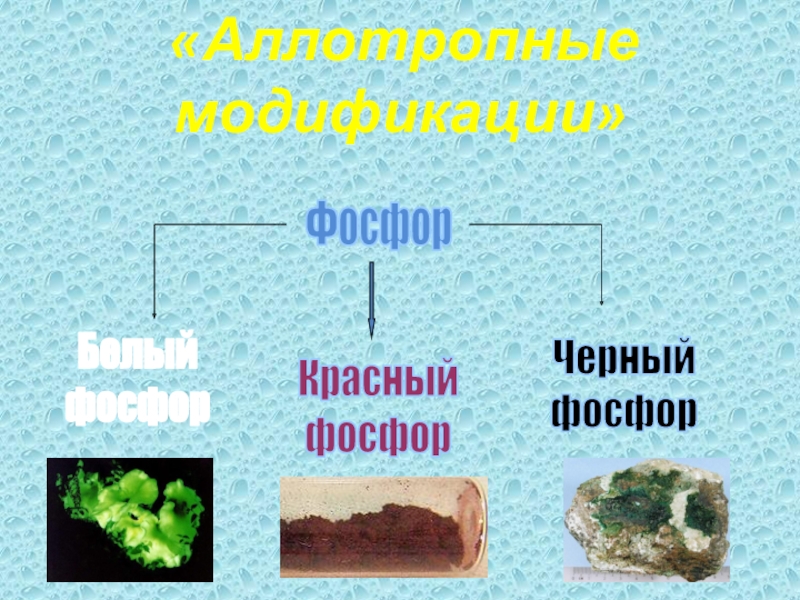
- 20. «Аллотропные модификации»ФосфорБелый фосфорКрасныйфосфорЧерный фосфор
- 21. Белый фосфорНаиболее распространен белый, или желтый, фосфор.
- 22. Красный фосфорАморфный темно-малиновый порошок без запаха. Менее
- 23. Черный фосфорРомбическая модификацияКубическая модификацияИмеет атомную кристаллическую решетку.
- 24. Слайд 24
- 25. Слайд 25
- 26. «Оловянная чума»
- 27. КАКОЕ ВПЕЧАТЛЕНИЕ У ВАС ОСТАЛОСЬ ОТ УРОКА?
- 28. СПАСИБО ЗА ВНИМАНИЕ!
Слайд 1МАСТЕР-КЛАСС УЧИТЕЛЯ ХИМИИ МОУ СОШ №1 С.ЧИКОЛА
ХАСЦАЕВОЙ ФАТИМЫ РАМАЗАНОВНЫ
« АЛЛОТРОПИЯ
Слайд 2ЦЕЛИ:
СФОРМИРОВАТЬ ПОНЯТИЕ ОБ АЛЛОТРОПИИ
РАССМОТРЕТЬ ПРИЧИНЫ АЛЛОТРОПИИ НА ПРИМЕРЕ ТАКИХ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ,
Слайд 3Слово «аллотропия»- происходит от греческого «аллос»-другой и « тропия »-поворот или
АЛЛОТРОПИЯ- явление существования одного и того же химического элемента в виде нескольких простых веществ
Слайд 5 ПРИЧИНЫ АЛЛОТРОПИИ
Образование молекул с
разным числом атомов( О2 и О3 ) кристаллических форм
( алмаз и графит )
Слайд 61. Элемент кислород находится в VI группе, главной подгруппе, II периоде,
Ar = 16.
2. Строение атома:
P11 = 8; n01 = 8; ē = 8
валентность II, степень окисления -2
(редко +2; +1; -1).
3. Входит в состав оксидов, оснований, солей, кислот, органических веществ, в том числе живых организмов- до 65% по массе.
Кислород как элемент
Слайд 9Физические свойства О2
Расворимость-0,031 м3 в 1 м3 воды
Газ - без цвета,
tкип= -183С; tпл = -219C; d по воздуху = 1,1.
При давлении 760 мм. рт.ст. и температуре
–183 С кислород сжижается
-1830 С
-2190 С
(Н. у.)
ГАЗ БЕЗ ЦВЕТА И ЗАПАХА
ЖИДКОСТЬ СИНЕГО ЦВЕТА
КРИСТАЛЛЫ СИНЕГО ЦВЕТА
Слайд 11Аллотропная модификация кислорода – озон О3
Неустойчив:
Сильный окислитель:
2KI + O3 + H2O 2KOH + I2 + O2
Обесцвечивает красящие вещества, отражает УФ - лучи, уничтожает микроорганизмы.
Слайд 12Под воздействием солнечного излучения или электрического разряда может происходить реакция:
В результате образуется озон .
Он отличается от обычного кислорода составом молекулы (О3 ) и свойствами.
Способы получения озона
Слайд 13Озон в природе
Содержание озона в воздухе:
Летом- до 7*10-9% (по объему), зимой-
В атмосфере максимальная его концентрация на высоте 20-25 км, где озон образует слой, защищающий Землю от УФ- лучей
Слайд 16Графит
кристаллическое аллотропное видоизменение углерода, в древности считалось минералом свинца
Слайд 19Фуллерены – молекулярная форма углерода
Названы по имени американского инженера и архитектора
Слайд 21Белый фосфор
Наиболее распространен белый, или желтый, фосфор. Белый фосфор имеет молекулярную
Это очень реакционноспособное, мягкое воскообразное вещество бледно-желтого цвета, с неприятным чесночным запахом, растворимое в сероуглероде и бензоле,
нерастворимое в воде. Очень ядовит. Воспламеняется при трении, обладает уникальной способностью светиться в темноте за счет медленного окисления.
Температура плавления – 44оС. В лаборатории его хранят под слоем воды. Смертельная доза– 0,1 г.
Слайд 22Красный фосфор
Аморфный темно-малиновый порошок без запаха. Менее активен, чем белый фосфор,
Слайд 23Черный фосфор
Ромбическая модификация
Кубическая модификация
Имеет атомную кристаллическую решетку.
По внешним признакам черный
Наименее активный из всех модификаций.