- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Алкены
Содержание
- 1. Презентация по химии на тему: Алкены
- 2. Цели: изучить химические свойства алкенов; формировать умение
- 3. Вариант 1СН3 – СН2 – С =
- 4. I. РЕАКЦИИ ПРИСОЕДИНЕНИЯ:1) с водородом (реакция гидрирования):
- 5. 3) с галогеноводородами (реакция гидрогалогенирования):СН3 – СН
- 6. 4) с водой (реакция гидратации):
- 7. II. Реакции окисления:3CH2 = CH2 + 2KMnO4
- 8. Реакции горения:Полное горение:
- 9. 1. В щелочной среде алкены окисляются до:а)
Слайд 2Цели: изучить химические свойства алкенов; формировать умение составлять уравнения реакций с
Оборудование: растворы KMnO4, Br2, спички, спиртовка.
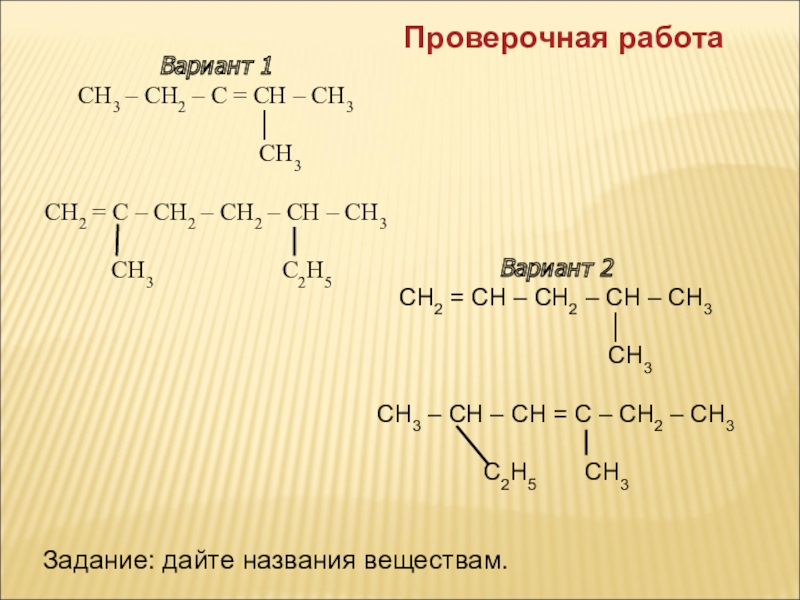
Слайд 3Вариант 1
СН3 – СН2 – С = СН – СН3
СН3
СН2 = С – СН2 – СН2 – СН – СН3
СН3 С2Н5
Вариант 2
СН2 = СН – СН2 – СН – СН3
│
СН3
СН3 – СН – СН = С – СН2 – СН3
С2Н5 СН3
Проверочная работа
Задание: дайте названия веществам.
Слайд 4I. РЕАКЦИИ ПРИСОЕДИНЕНИЯ:
1) с водородом (реакция гидрирования):
СН3 – СН2 – СН = СН2 + Н2 → СН3 – СН2 – СН2 – СН3
бутан
2) с галогенами (реакция галогенирования):
СН2 = СН2 + Br2 → CH2 – CH2
│ │
Br Br
дибромэтан
СН2 = СН2 + Br2 → идет обесцвечивание раствора брома, это качественная реакция на обнаружение двойной связи.
Слайд 53) с галогеноводородами (реакция гидрогалогенирования):
СН3 – СН = СН2 + НBr
│
Br
2-бромпропан
Эта реакция идет по правилу Марковникова: при присоединении галогеноводорода к алкену, водород присоединяется к более гидрированному атому углерода, т.е. атому, при котором находится больше атомов водорода, а галоген – к менее гидрированному.
Слайд 64) с водой (реакция гидратации):
t0
CH2 = CH2 + H2O → CH3 – CH2 – OH
этанол
СН3 – СН = СН2 + Н2О → СН3 – СН – СН3
│
ОН
пропанол-2
Эта реакция также идёт по правилу Марковникова.
5) реакция полимеризации:
УФ-свет
nCH2 = CH2 −→ ( – CH2 – CH2 – )n
Слайд 7II. Реакции окисления:
3CH2 = CH2 + 2KMnO4 + 4H2O → 3CH2
│ │
ОН ОН
этандиол-1,2
этиленгликоль
CH2 = CH2 + [O] = обесцвечивание раствора перманганата калия.
Эта реакция является качественной на двойную связь.
5СН3 – СН = СН – СН3 + 8KMnO4 + 12H2SO4 → 10СН3 – СООН +
+ 8MnSO4 + 4K2SO4 + 12H2O
Слайд 8Реакции горения:
Полное горение:
CH2 = CH2 + 3О2 → 2СО2 + 2Н2О
Неполное горение:
PdCl2
2СН2 = СН2 + О2 → 2СН3 – СНО
CuCl2
Слайд 91. В щелочной среде алкены окисляются до:
а) алкинов; б) одноатомных
г) альдегидов
2. Для алкенов характерными реакциями являются:
а) реакции присоединения; б) реакции окисления; в) реакции
изомеризации; г) реакции отщепления
3. При полном сгорании алкенов образуются:
а) углекислый газ и вода; б) углекислый газ и водород; в) альдегид;
г) карбоновая кислота и вода
4. Качественной реакцией на алкены является:
а) взаимодействие с бромом; б) взаимодействие с водой;
в) взаимодействие с галогеноводородами; г) взаимодействие с
кислородом
5. Алкены в кислой среде окисляются до:
а) многоатомных спиртов; б) одноатомных спиртов;
в) карбоновых кислот; г) альдегидов