- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Алкены. Физические и химические свойства
Содержание
- 1. Презентация по химии на тему: Алкены. Физические и химические свойства
- 2. Физические свойства алкеновЭтилен — бесцветный газ, почти без запаха, немного легче воздуха, плохо растворим в воде.Этилен
- 3. SbroolsПропиленФизические свойства алкеновБутенПропилен и бутилен — также
- 4. Алкены плохо растворимыв воде, но хорошо —
- 5. Химические свойства алкеновДвойная связь в алкенах состоитиз
- 6. Кратная связь представляет собой область повышенной электронной
- 7. Реакции присоединенияРеакция гидрирования (гидрогенизация) — это реакция
- 8. Реакции присоединенияАлкены вступают в реакцию галогенирования — это реакция взаимодействия с галогенами.CnH2n + Г2 → CnH2nГ2
- 9. Периодическая система химических элементов Дмитрия Ивановича Менделеева
- 10. Качественной реакцией для алкенов является обесцвечивание бромной
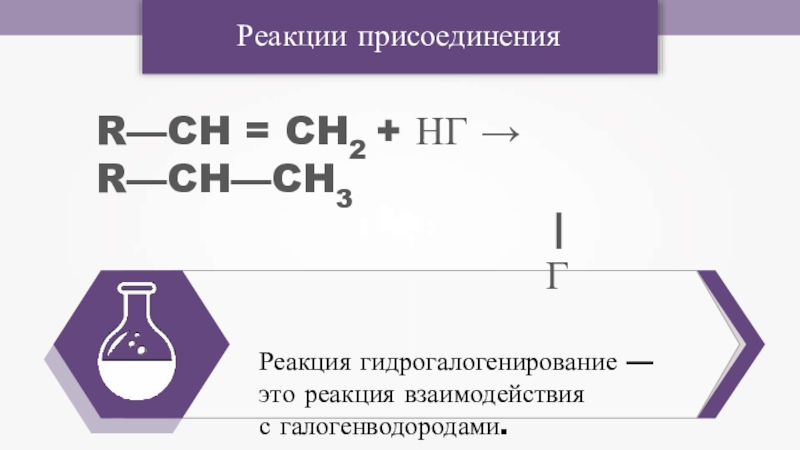
- 11. Реакции присоединенияR—CH = CH2 + НГ → R—CH—CH3| ГРеакция гидрогалогенирование — это реакция взаимодействияс галогенводородами.
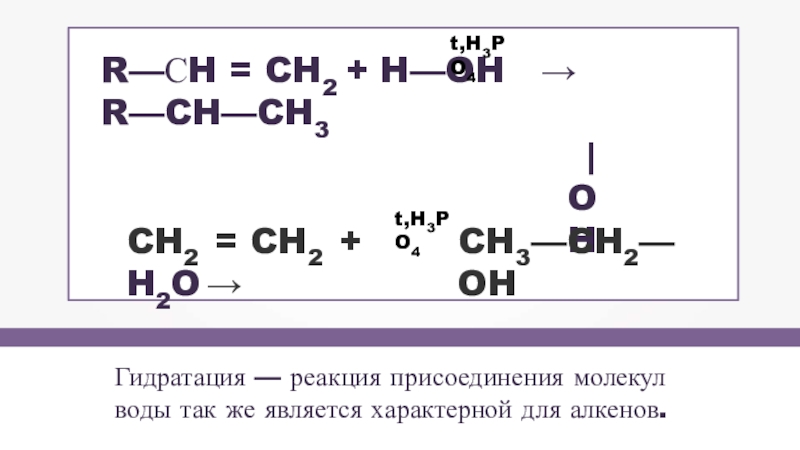
- 12. Гидратация — реакция присоединения молекулводы так же
- 13. Марковников Владимир Васильевич 1803–1873 гг.Присоединение галогенводородов и водык несимметричным алкенам происходит по правилу Марковникова Владимира Васильевича.
- 14. Ещё одной характерной реакцией для алкенов и для всех органических соединений является реакция окисления.
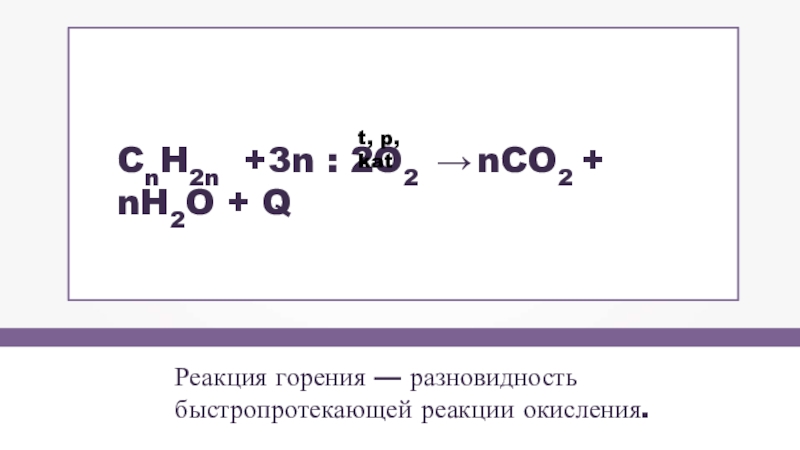
- 15. Реакция горения — разновидностьбыстропротекающей реакции окисления.CnH2n +3n : 2O2 → nCO2 + nH2O + Qt, p, kat
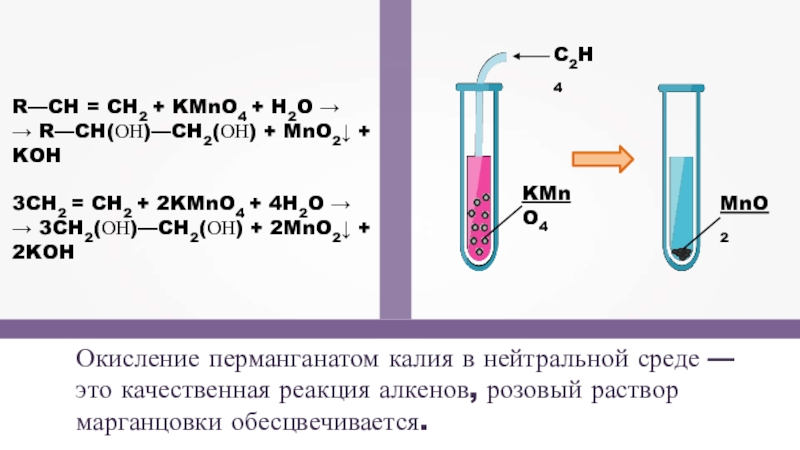
- 16. Окисление перманганатом калия в нейтральной среде —
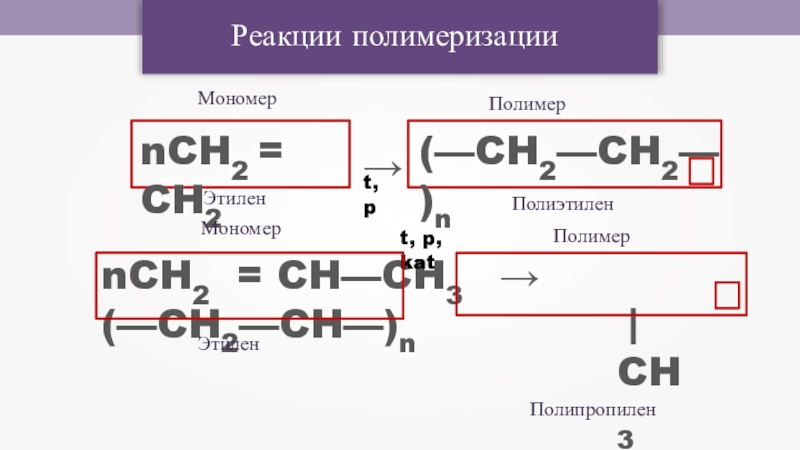
- 17. Реакции полимеризацииnCH2 = CH2(—CH2—CH2—)n→t, pnCH2 = CH—CH3 → (—CH2—CH—)n|CH3t, p, katМономерПолимерПолимерЭтилен МономерПолиэтиленПолипропиленЭтилен
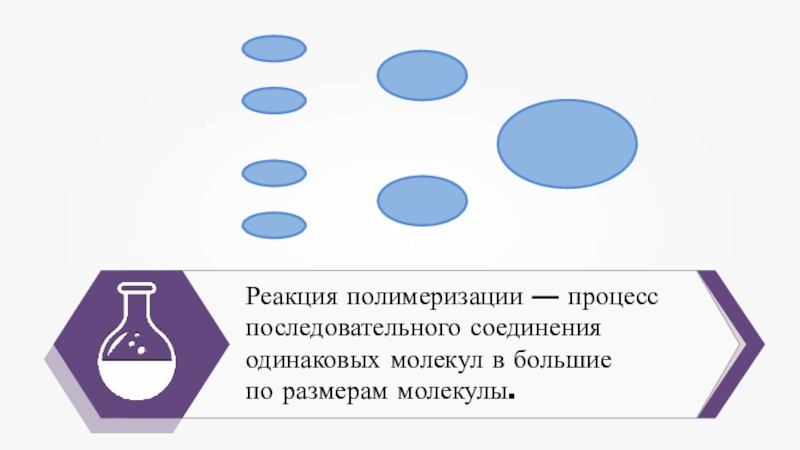
- 18. Реакция полимеризации — процесс последовательного соединения одинаковых молекул в большиепо размерам молекулы.
- 19. Этиленовые углеводороды с воздухом образуют небезопасные взрывныесмеси, про это надо помнить во время работы с ними.
- 20. Для этиленовых углеводородов характерны реакции:присоединения;окисления;полимеризации.
Слайд 1Непредельные углеводороды содержат одну или несколько углеродных связей.
Простейший представитель —
этилен или
Слайд 2Физические свойства алкенов
Этилен — бесцветный газ, почти без запаха, немного легче
Этилен
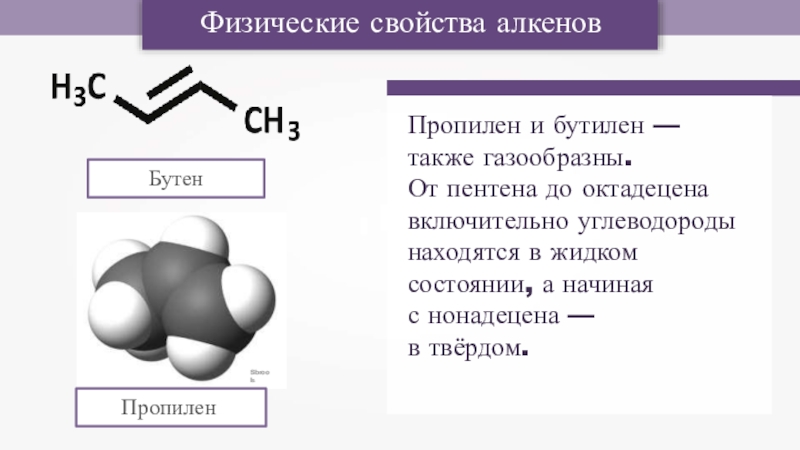
Слайд 3Sbrools
Пропилен
Физические свойства алкенов
Бутен
Пропилен и бутилен — также газообразны.
От пентена до октадецена
с нонадецена — в твёрдом.
Слайд 4Алкены плохо растворимы
в воде, но хорошо — в органических
растворителях. Этилен и
Физические свойства алкенов
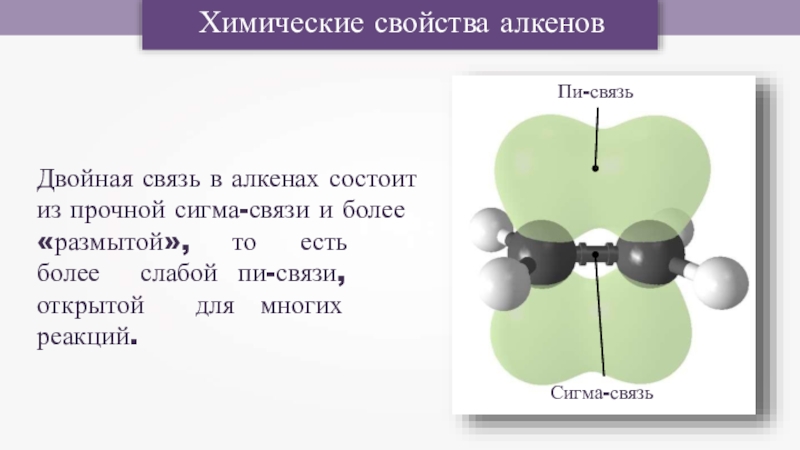
Слайд 5Химические свойства алкенов
Двойная связь в алкенах состоит
из прочной сигма-связи и более
«размытой»,
Сигма-связь
Пи-связь
Слайд 6Кратная связь представляет собой область повышенной электронной плотности, которая доступна для
Слайд 7Реакции присоединения
Реакция гидрирования (гидрогенизация) — это реакция взаимодействия с водородом, которая
t, Ni
CnH2n + H2 → CnH2n+2
Слайд 8Реакции присоединения
Алкены вступают в реакцию галогенирования — это реакция взаимодействия с
CnH2n + Г2 → CnH2nГ2
Слайд 10Качественной реакцией для алкенов является обесцвечивание бромной воды, которая изначально имеет
СH2 = CH2 + Br2→CH2—CH2
| |
Br Br
Слайд 11Реакции присоединения
R—CH = CH2 + НГ → R—CH—CH3
| Г
Реакция гидрогалогенирование —
с галогенводородами.
Слайд 12Гидратация — реакция присоединения молекул
воды так же является характерной для алкенов.
R—СH
| OH
t,H3PO4
CH2 = CH2 + H2O →
CH3—CH2—OH
t,H3PO4
Слайд 13Марковников Владимир Васильевич 1803–1873 гг.
Присоединение галогенводородов и воды
к несимметричным алкенам происходит
Слайд 14Ещё одной характерной реакцией для алкенов и для всех органических соединений
Слайд 15Реакция горения — разновидность
быстропротекающей реакции окисления.
CnH2n +3n : 2O2 → nCO2 +
t, p, kat
Слайд 16Окисление перманганатом калия в нейтральной среде — это качественная реакция алкенов,
R—CH = CH2 + KMnO4 + H2O →
→ R—CH(ОН)—CH2(ОН) + MnO2↓ + KOH
3CH2 = CH2 + 2KMnO4 + 4H2O →
→ 3CH2(ОН)—CH2(ОН) + 2MnO2↓ + 2KOH
KMnO4
C2H4
MnO2
Слайд 17Реакции полимеризации
nCH2 = CH2
(—CH2—CH2—)n
→t, p
nCH2 = CH—CH3 → (—CH2—CH—)n
|
CH3
t, p, kat
Мономер
Полимер
Полимер
Этилен
Полиэтилен
Полипропилен
Этилен