АЛКЕНЫ
(урок по общеобразовательной дисциплине - химия 1 курс СПО)
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Алкены
Содержание
- 1. Презентация по химии на тему Алкены
- 2. Байкова Елена Геннадьевнапреподаватель химииВысшей квалификационной категорииГАПОУ СПО
- 3. Цель урока: сформировать представление об алкенах, спрогнозировать их химические свойства, основываясь на особенностях строения.
- 4. Задачи урока: познакомиться с гомологическим рядом этиленовых
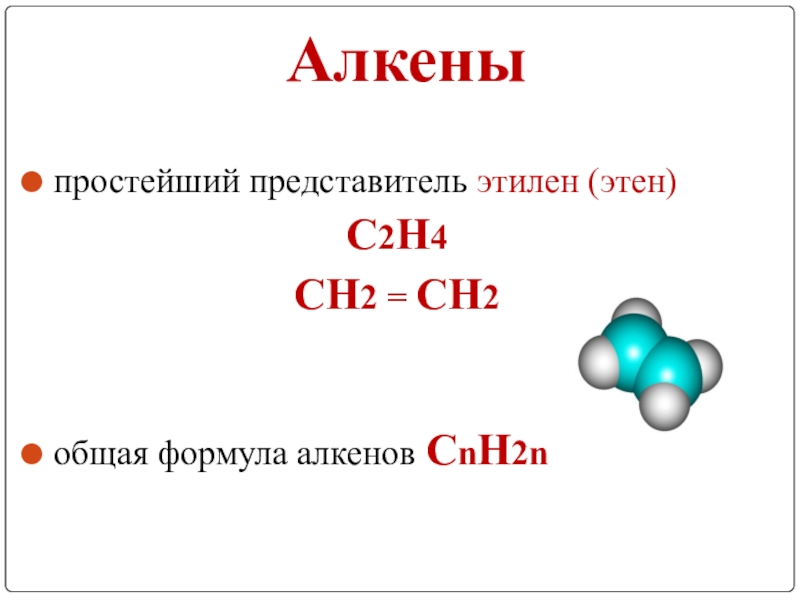
- 5. Алкеныпростейший представитель этилен (этен)С2Н4 СН2 = СН2 общая формула алкенов СnН2n
- 6. Выпишите формулы веществ, которые можно отнести
- 7. Алкены –это углеводороды , в молекулах которых содержится одна двойная углерод – углеродная связь.
- 8. Номенклатура алкеновВ качестве главной выбрать самую длинную
- 9. Химические свойства Реакции присоединения:гидрирования
- 10. Химические свойства Реакции присоединения:гидрогалогенированияСН2 = СН2 +
- 11. Химические свойства Реакции присоединения:реакция полимеризации.n СН2 =
- 12. Получение этиленареакцией деполимеризации полиэтилена можно получить этилен.
- 13. Получение этилена и опыты с нимВ лабораторных
- 14. Получение этилена и опыты с нимКачественная реакция
- 15. Получение этилена и опыты с нимКачественная реакция
- 16. Получение этилена и опыты с нимГорение этиленаC2H4 + 3O2 → 2CO2 + 2H2O
- 17. Отметьте в
- 18. РефлексияПродолжите фразы:Сегодня на занятии я узнал… .Теперь я могу… .Было интересно…Выберите себя в конце урока.
- 19. Задание для внеаудиторной работы Напишите реакции взаимодействия
Байкова Елена Геннадьевнапреподаватель химииВысшей квалификационной категорииГАПОУ СПО ВО «Гусь – Хрустальный Технологический колледж»АЛКЕНЫ (урок по общеобразовательной дисциплине - химия 1 курс СПО)
Слайд 2Байкова Елена Геннадьевна
преподаватель химии
Высшей квалификационной категории
ГАПОУ СПО ВО
«Гусь – Хрустальный
Технологический колледж»
Слайд 3Цель урока:
сформировать представление об алкенах,
спрогнозировать их химические свойства,
основываясь на особенностях строения.
Слайд 4Задачи урока:
познакомиться с гомологическим рядом этиленовых углеводородов;
рассмотреть особенности строения этилена, изомерию
и номенклатуру алкенов;
выявить свойства характерные для алкенов;
познакомиться со способами получения алкенов;
рассмотреть области их применения.
выявить свойства характерные для алкенов;
познакомиться со способами получения алкенов;
рассмотреть области их применения.
Слайд 6 Выпишите формулы веществ, которые можно отнести к алкенам, в порядке
увеличения числа атомов углерода
С4Н8, СН4, С5Н12, С2Н4, С3Н4, С7Н16, С2Н2, С6Н6, С3Н6, С5Н10.
Слайд 7Алкены –
это углеводороды , в молекулах которых содержится одна двойная углерод
– углеродная связь.
Слайд 8Номенклатура алкенов
В качестве главной выбрать самую длинную углеводородную цепь, содержащую двойную
связь и с которой связано наибольшее число заместителей.
Пронумеровать атомы углерода с того конца цепи где ближе находится двойная связь.
Цифрами указать номера атомов углерода, с которыми связаны радикалы, назвать радикалы в алфавитном порядке.
Назвать главную цепь.
Цифрой после названия алкена указать меньший номер атома углерода, образующего двойную связь.
Пронумеровать атомы углерода с того конца цепи где ближе находится двойная связь.
Цифрами указать номера атомов углерода, с которыми связаны радикалы, назвать радикалы в алфавитном порядке.
Назвать главную цепь.
Цифрой после названия алкена указать меньший номер атома углерода, образующего двойную связь.
Слайд 9Химические свойства
Реакции присоединения:
гидрирования
Ni, t
СН2 = СН2 + Н2 → СН3 - СН3
галогенирования
СН2 = СН2 + Сl2 → СН2Сl – СН2Сl
1,2 - дихлорэтан
СН2 = СН2 + Н2 → СН3 - СН3
галогенирования
СН2 = СН2 + Сl2 → СН2Сl – СН2Сl
1,2 - дихлорэтан
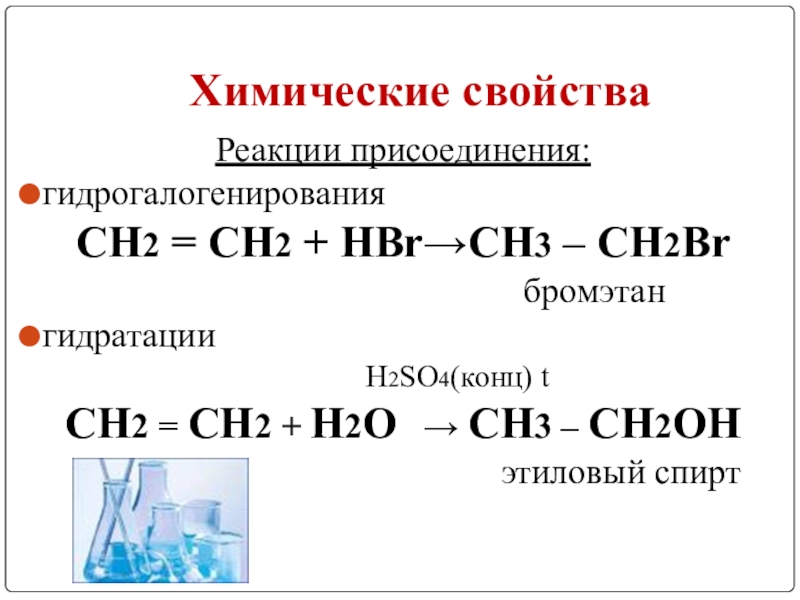
Слайд 10Химические свойства
Реакции присоединения:
гидрогалогенирования
СН2 = СН2 + НBr→СН3 – СН2Br
бромэтан
гидратации
H2SO4(конц) t
СН2 = СН2 + Н2O → СН3 – СН2OH
этиловый спирт
гидратации
H2SO4(конц) t
СН2 = СН2 + Н2O → СН3 – СН2OH
этиловый спирт
Слайд 11Химические свойства
Реакции присоединения:
реакция полимеризации.
n СН2 = СН2→ (-СН2 - СН2-)n
мономер полимер
этилен полиэтилен
этилен полиэтилен
Слайд 12Получение этилена
реакцией деполимеризации полиэтилена можно получить этилен.
Al2O3,t
(-СН2
- СН2-)n → n СН2 = СН2
Слайд 13Получение этилена и опыты с ним
В лабораторных условиях этилен можно получить
из этилового спирта
H2SO4(конц) t
СН3 – СН2OH → СН2 = СН2 + Н2O
H2SO4(конц) t
СН3 – СН2OH → СН2 = СН2 + Н2O
Слайд 14Получение этилена и опыты с ним
Качественная реакция на этилен
обесцвечивание перманганата калия
KMnO4
СН2 = СН2 + [О] + Н2O →
СН2 ОН - СН2ОН
этиленгликоль
СН2 = СН2 + [О] + Н2O →
СН2 ОН - СН2ОН
этиленгликоль
Слайд 15Получение этилена и опыты с ним
Качественная реакция на этилен
обесцвечивание бромной воды
СН2
= СН2 + Br2 → СН2Br – СН2Br
1,2 - дибромэтан
1,2 - дибромэтан
Слайд 17 Отметьте в таблице области применения перечисленных в ней химических свойств этилена.
Из букв, соответствующих правильных ответам, вы составите название основного компонента природного газа:
Слайд 18Рефлексия
Продолжите фразы:
Сегодня на занятии я узнал… .
Теперь я могу… .
Было интересно…
Выберите
себя в конце урока.
Слайд 19Задание для внеаудиторной работы
Напишите реакции взаимодействия пропилена с веществами:
H2
, H2O, HBr, Br2, O2 ,
предварительно ознакомившись с правилом В.В. Марковникова
(Габриелян О. С. Химия 10 базовый уровень § 4)
предварительно ознакомившись с правилом В.В. Марковникова
(Габриелян О. С. Химия 10 базовый уровень § 4)