- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Алкены (10 класс)
Содержание
- 1. ПРезентация по химии на тему Алкены (10 класс)
- 2. Строение молекулыК непредельным относят углеводороды, содержащие в
- 3. Орбитали атомов углерода, между которыми имеется двойная
- 4. Оси гибридных орбиталей атомов, образующих двойную связь,
- 5. Гомологический ряд этена
- 6. Изомерия и номенклатураСтруктурная изомерия1) изомерия углеродного скелета:2) изомерия положения двойной связи:
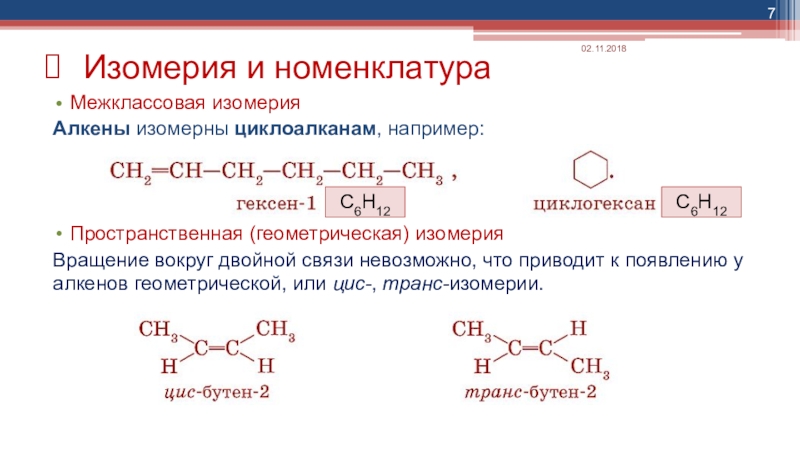
- 7. Межклассовая изомерияАлкены изомерны циклоалканам, например:Пространственная (геометрическая) изомерияВращение
- 8. 1. Определения главной цепи – самой длинной цепочки
- 9. Получение алкеновРассмотрим основные способы получения алкенов в промышленностив лаборатории
- 10. Получение – в промышленности Крекинг нефтепродуктов. В
- 11. Дегидратация спиртов (отщепление воды). Воздействие водоотнимающих средств
- 12. Дегидрогалогенирование (отщепление галогеноводорода).При взаимодействии галогеналкана с щёлочью
- 13. Дегалогенирование. При действии цинка или магния на
- 14. Химические свойства алкеновРеакции присоединенияРеакции полимеризацииРеакции окисления
- 15. Химические свойстваОтличительной чертой представителей непредельных углеводородов - алкенов
- 16. Галогенирование (присоединение галогенов).Взаимодействие алкена с бромной водой
- 17. Гидрогалогенирование (присоединение галогеноводорода):Эта реакция подчиняется правилу Марковникова:Химические свойства?
- 18. Гидратация (присоединение воды). Гидратация алкенов приводит к
- 19. Реакция полимеризации – особый случай реакции присоединения:Реакции
- 20. Реакции окисленияАлкены горят в кислороде с образованием
- 21. Применение алкеновАлкены широко используются в химической промышленности
- 22. Источники
Слайд 2Строение молекулы
К непредельным относят углеводороды, содержащие в молекулах кратные связи между
Свойство «непредельности» связано со способностью этих веществ вступать в реакции присоединения, прежде всего водорода, с образованием предельных, или насыщенных, углеводородов – алканов.
По названию первого представителя гомологического ряда – этилена – алкены называют этиленовыми углеводородами.
Слайд 3Орбитали атомов углерода, между которыми имеется двойная связь, находятся в состоянии
Это означает, что в гибридизации участвуют одна s- и две p-орбитали, а одна p-орбиталь остаётся негибридизованной.
Перекрывание гибридных орбиталей приводит к образованию σ-связи, а за счёт негибридизованных p-орбиталей соседних атомов углерода образуется вторая, π-связь.
Вывод: двойная связь состоит из одной σ- и одной π-связи.
Строение молекулы
Слайд 4Оси гибридных орбиталей атомов, образующих двойную связь, находятся в одной плоскости,
Двойная связь (0,132 нм) короче одинарной, а её энергия больше, т. е. она является более прочной. Тем не менее наличие подвижной, легко поляризуемой π-связи приводит к тому, что алкены химически более активны, чем алканы, и способны вступать в реакции присоединения.
Строение молекулы
Слайд 6Изомерия и номенклатура
Структурная изомерия
1) изомерия углеродного скелета:
2) изомерия положения двойной связи:
Слайд 7Межклассовая изомерия
Алкены изомерны циклоалканам, например:
Пространственная (геометрическая) изомерия
Вращение вокруг двойной связи невозможно,
Изомерия и номенклатура
С6Н12
С6Н12
Слайд 81. Определения главной цепи – самой длинной цепочки атомов углерода в молекуле.
2. Нумерация атомов главной цепи начинается с того конца, к которому ближе находится двойная связь.
Если по расположению двойной связи нельзя определить начало нумерации атомов в цепи, то его определяет положение заместителей так же, как для предельных углеводородов.
3. Формирование названия. В конце названия указывают номер атома углерода, у которого начинается двойная связь, и суффикс, обозначающий принадлежность соединения к классу алкенов, -ен.
Изомерия и номенклатура
5-метилгексен-2
Номенклатура алкенов, разработанная ИЮПАК, схожа с номенклатурой алканов.
Слайд 10Получение – в промышленности
Крекинг нефтепродуктов.
В процессе термического крекинга предельных
Дегидрирование предельных углеводородов.
При пропускании алканов над катализатором (Pt, Ni, Cr2O3) при высокой температуре (400—600 °С) происходит отщепление молекулы водорода и образование алкена.
Слайд 11Дегидратация спиртов (отщепление воды).
Воздействие водоотнимающих средств (H2SO4, Al2O3) на одноатомные
Получение – в лаборатории
Слайд 12Дегидрогалогенирование (отщепление галогеноводорода).
При взаимодействии галогеналкана с щёлочью в спиртовом растворе образуется
Реакция идёт по правилу Зайцева:
Получение – в лаборатории
Слайд 13Дегалогенирование.
При действии цинка или магния на дибромпроизводное алкана происходит отщепление
Получение – в лаборатории
Слайд 15Химические свойства
Отличительной чертой представителей непредельных углеводородов - алкенов является способность вступать в
Гидрирование алкенов.
Алкены способны присоединять водород в присутствии катализаторов гидрирования — металлов — платины, палладия, никеля:
Слайд 16Галогенирование (присоединение галогенов).
Взаимодействие алкена с бромной водой или раствором брома в
Химические свойства
Данная реакция является качественной реакцией на кратную связь (= или ≡) и применяется для обнаружения непредельных углеводородов.
Признак реакции – обесцвечивание бромной воды.
Слайд 17Гидрогалогенирование (присоединение галогеноводорода):
Эта реакция подчиняется правилу Марковникова:
Химические свойства
?
Слайд 18Гидратация (присоединение воды).
Гидратация алкенов приводит к образованию спиртов.
При присоединении
этиловый спирт:
При гидратации пропена или других алкенов образуются вторичные или третичные спирты:
Химические свойства
Слайд 19Реакция полимеризации – особый случай реакции присоединения:
Реакции полимеризации веществ, содержащих двойную
Химические свойства
Слайд 20Реакции окисления
Алкены горят в кислороде с образованием CO2 и H2O:
Алкены легко
Химические свойства
Качественна реакция на кратную углерод-углеродную связь
Слайд 21Применение алкенов
Алкены широко используются в химической промышленности как сырьё для получения
Этен - исходное вещество для производства этанола, этиленгликоля, эпоксидов, дихлорэтана.
Большое количество этена перерабатывается в полиэтилен, который используется для изготовления упаковочной плёнки, посуды, труб, электроизоляционных материалов.
Из пропена получают глицерин, ацетон, изопропиловый спирт, растворители.
Полимеризацией пропена получают полипропилен, который по многим показателям превосходит полиэтилен: имеет более высокую температуру плавления, химическую устойчивость.
В настоящее время из полимеров - аналогов полиэтилена производят волокна, обладающие уникальными свойствами. Так, например, волокно из полипропилена - одно из самых прочных синтетических волокон.
Материалы, изготовленные из этих волокон, являются перспективными и находят всё большее применение в разных областях человеческой деятельности.