- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Алкены (10 класс)
Содержание
- 1. Презентация по химии на тему Алкены (10 класс)
- 2. Строение молекулыCnH2nХимическиесвойстваИзомерияФизическиесвойстваПроверка знанийПолучениеНоменклатураПрименениеАлкены
- 3. Алкены (олефины)– ациклические углеводороды, в молекуле которых
- 4. δ Строение молекулыsp2-гибридизацияУгол связи – 1200Форма
- 5. НСНоменклатура1. Выбор главной цепи.НН3ССССССН3ННН32. Нумерация атомов главной цепи.НН3ССССССН3ННН3123453. Формирование названия.НН3СССССН3НН34 - метилпентен - 2
- 6. СН2СНСН3НИзомерия1. Структурная изомерия.СН2СН3ССН2СН3ССН2бутен - 1метилпропен2. Изомерия положения
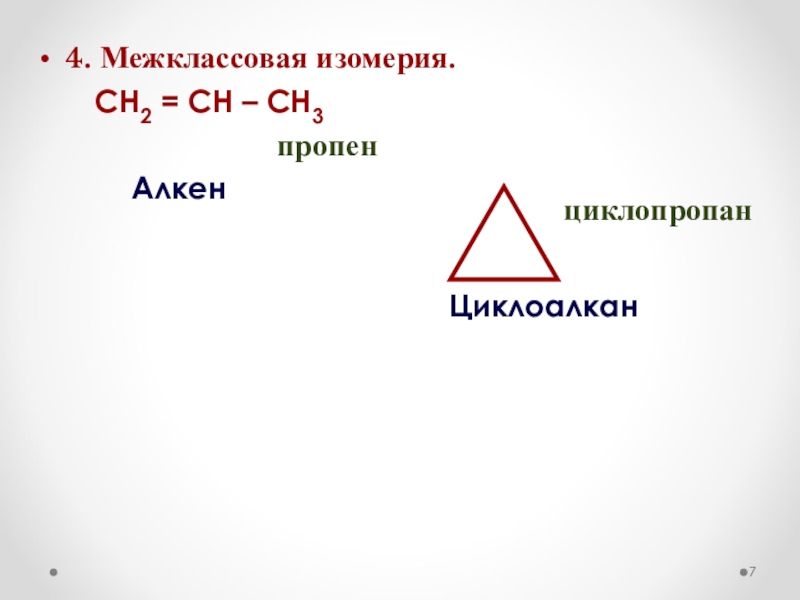
- 7. 4. Межклассовая изомерия. СН2
- 8. ФизическиесвойстваАгрегатное состояние:С2Н4 – С4Н8газообразные вещества;С5Н10 – С18Н36жидкости;с
- 9. Химическиесвойства+ Н2, t0, Ni+ Hal2+ HHal+ H2O,
- 10. Химические свойства алкенов
- 11. Гидратация (присоединение воды)
- 12. Горение СН2 = СН2
- 13. BrСН2Получение1. Крекинг нефтепродуктов:С16Н34С8Н18+ С8Н162. Дегидрирование предельных углеводородов:СН3СН2СН2СН3СН2СНСН2СН3+
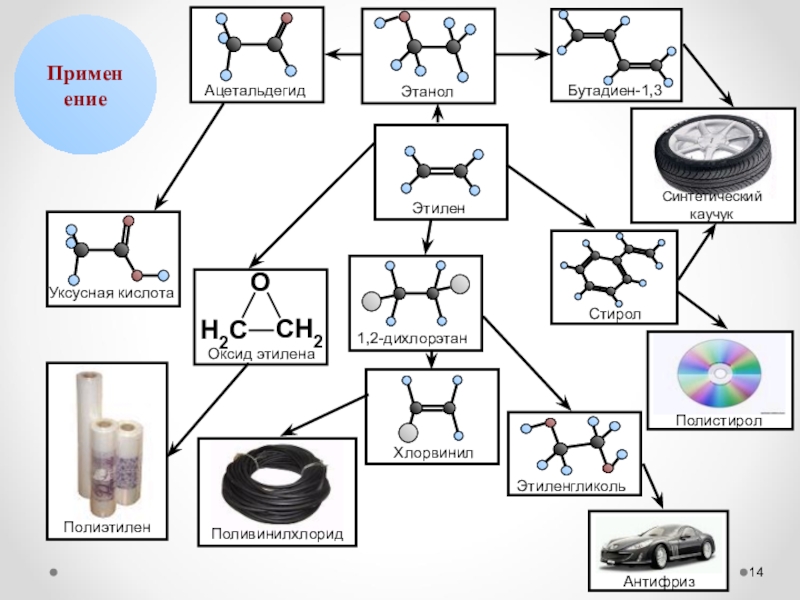
- 14. Применение
- 15. Проверка знанийВопрос 1УРА!Попробуй ещеПопробуй ещеПопробуй ещеCnH2n+2АCnH2nВCnH2n-2ГCnH2n-6БОбщая формула
- 16. Спасибо за работу на уроке!
Слайд 2 Строение
молекулы
CnH2n
Химические
свойства
Изомерия
Физические
свойства
Проверка
знаний
Получение
Номенклатура
Применение
Алкены
Слайд 3Алкены (олефины)– ациклические углеводороды, в молекуле которых кроме одинарных связей содержится
Общая формула: СnH2n
CnH2n
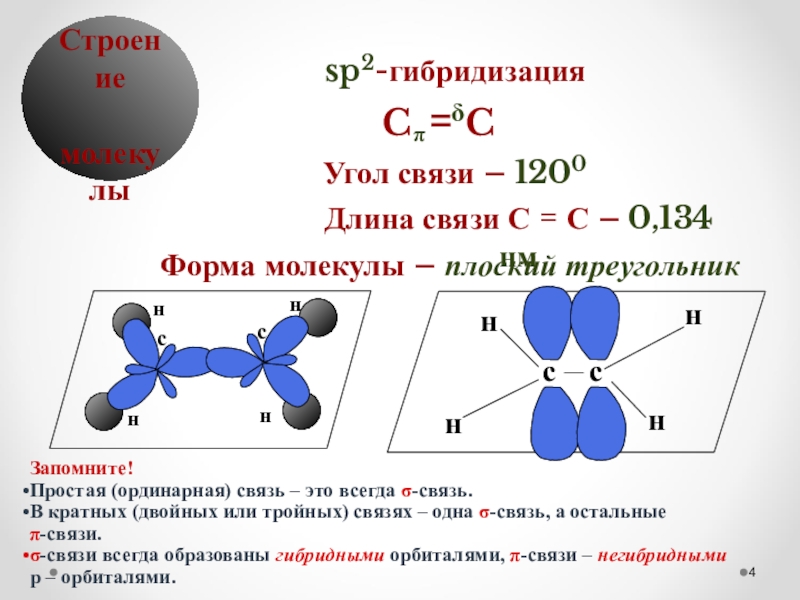
Слайд 4δ
Строение
молекулы
sp2-гибридизация
Угол связи – 1200
Форма молекулы – плоский треугольник
C
π
C
Длина связи С = С – 0,134 нм
Запомните!
Простая (ординарная) связь – это всегда σ-связь.
В кратных (двойных или тройных) связях – одна σ-связь, а остальные
π-связи.
σ-связи всегда образованы гибридными орбиталями, π-связи – негибридными
p – орбиталями.
Слайд 5Н
С
Номенклатура
1. Выбор главной цепи.
Н
Н3
С
С
С
С
С
СН3
Н
Н
Н3
2. Нумерация атомов главной цепи.
Н
Н3
С
С
С
С
С
СН3
Н
Н
Н3
1
2
3
4
5
3. Формирование названия.
Н
Н3
С
С
С
С
СН3
Н
Н3
4 -
н
- 2
Слайд 6СН2
СН
СН3
Н
Изомерия
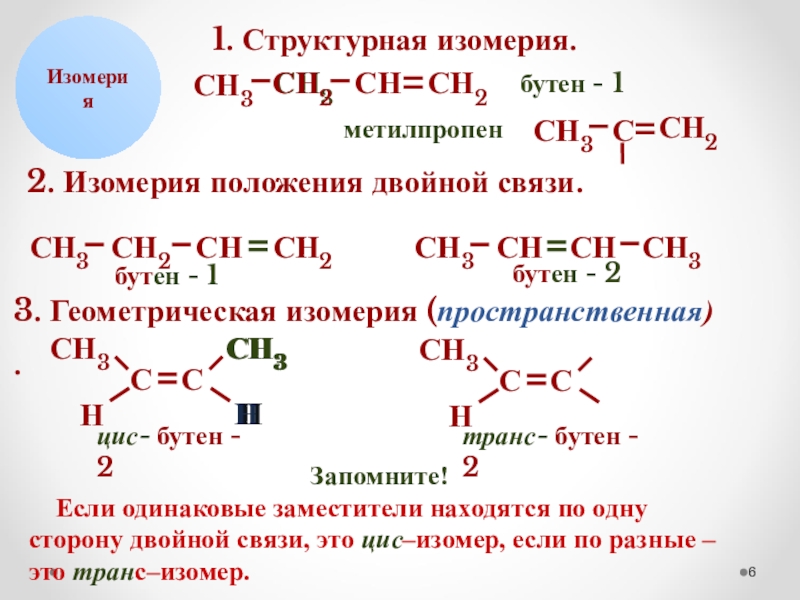
1. Структурная изомерия.
СН2
СН3
С
СН2
СН3
С
СН2
бутен - 1
метилпропен
2. Изомерия положения двойной связи.
СН3
СН2
СН
СН3
СН
СН3
бутен - 1
бутен
3. Геометрическая изомерия (пространственная)
.
СН3
Н
СН3
Н
С
С
СН3
Н
С
С
цис- бутен - 2
транс- бутен - 2
СН3
Н
Запомните!
Если одинаковые заместители находятся по одну сторону двойной связи, это цис–изомер, если по разные – это транс–изомер.
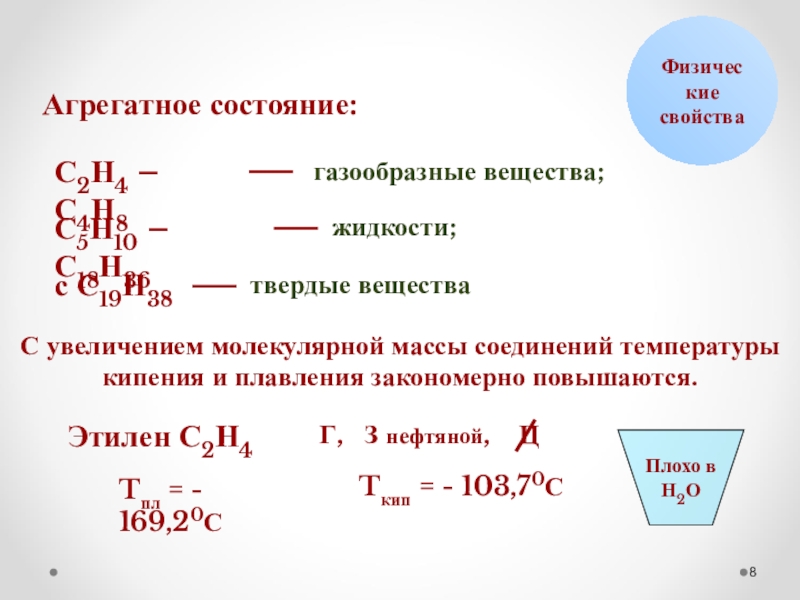
Слайд 8Физические
свойства
Агрегатное состояние:
С2Н4 – С4Н8
газообразные вещества;
С5Н10 – С18Н36
жидкости;
с С19Н38
твердые вещества
Этилен С2Н4
С увеличением
Tпл = - 169,20С
Tкип = - 103,70С
Плохо в
Н2О
Слайд 9Химические
свойства
+ Н2, t0, Ni
+ Hal2
+ HHal
+ H2O, t0, H+
+ H2O +
+ O2, t0 (горение)
- H2, t0, Ni
+ nCnH2n
CnH2n+2
дигалогеналканы, СnH2nHal2
галогеналканы, СnH2n+1Hal
CnH2n+1OH
CnH2n(OH)2
CO2 + H2O
CnH2n-2
полимер
СnH2n
этилен
Слайд 10Химические свойства алкенов
Гидрирование СН2 = СН – СН3 + Н2 → СН3 – СН2 – СН3
Галогенирование СН2 = СН2 + Br2(р-р) → СН2Br – СН2Br
Приведенная реакция – обесцвечивание алкеном бромной воды является качественной реакцией на двойную связь.
Гидрогалогенирование СН2 = СН2 + НBr → СН3 – СН2Br
Присоединение галогеноводородов к пропилену и другим несимметричным алкенам происходит в соответствии с правилом В.В. Марковникова (водород присоединяется к наиболее гидрогенизированному атому углерода при двойной связи, то есть к атому углерода с наибольшим числом водородных атомов).
СН2 = СН – СН3 + НBr → СН3 – СН2Br – СН3
Слайд 11Гидратация (присоединение воды)
t, H3PO4
СН2 =
Присоединение воды к пропилену и другим несимметричным алкенам происходит в соответствии с правилом В.В. Марковникова
СН2 = СН – СН3 + Н2О → СН3 – СН2ОН – СН3
Мягкое окисление окислителем (KMnO4, K2Cr2O7 и т.п.)
СН2 = СН2 + [O] + Н2О → СН2ОН – СН2ОН (этандиол или этиленгликоль) реакция Вагнера
В результате реакции наблюдается обесцвечивание раствора перманганата калия.
Реакция Вагнера служит качественной пробой на двойную связь.
Слайд 12
Горение СН2 = СН2 + 2О2 → СО2
t, Ni
Дегидрирование СН2 = СН2 → СН ≡ СН + Н2
cat
Полимеризация nСН2 = СН2 → (…– СН2 – СН2 –…)n
мономер
полимер
Реакцией полимеризации называется процесс образования высоко-молекулярного соединения (полимера) путем соединения друг с другом молекул исходного низкомолекулярного соединения (мономера). При полимеризации двойные связи в молекулах исходного непредельного соединения "раскрываются", и за счет образующихся свободных валентностей эти молекулы соединяются друг с другом.
Слайд 13Br
СН2
Получение
1. Крекинг нефтепродуктов:
С16Н34
С8Н18
+ С8Н16
2. Дегидрирование предельных углеводородов:
СН3
СН2
СН2
СН3
СН2
СН
СН2
СН3
+ Н2
СН3
СН
СН
СН3
+ Н2
3. Дегидратация спиртов
СН3
СН2
ОН
Н2SО4 , 140 – 1500С
СН2
+ Н2О
4. Дегидрогалогенирование (отщепление галогеноводорода):
СН3
СН2
СН3
+ NaОН
спирт, t
СН
СН3
СН
СН
СН3
+NaBr
+Н2О
5. Дегалогенирование:
СН3
СН
СН3
СН
+Zn
Br
Br
СН3
СН
СН
СН3
+ZnBr2
Слайд 15Проверка
знаний
Вопрос 1
УРА!
Попробуй еще
Попробуй еще
Попробуй еще
CnH2n+2
А
CnH2n
В
CnH2n-2
Г
CnH2n-6
Б
Общая формула алкенов
УРА!
Попробуй еще
Попробуй еще
Попробуй еще
sp2,sp2,sp2
А
sp,sp,sp2
Б
Тип
атомов углерода
в пропене
sp2,sp2,sp3
Г
sp2,sp,sp3
В
Вопрос 2
УРА!
Попробуй еще
Попробуй еще
Попробуй еще
углеродного
скелета
А
положения
кратной связи
Б
Какой тип изомерии
отсутствует у алкенов
геометрическая
положения
функциональной
группы
Вопрос 3
В
Г
УРА!
Попробуй еще
Попробуй еще
Попробуй еще
замещения
окисления
Б
Алкенам не характерны
реакции
полимеризации
присоединения
Г
Вопрос 4
А
В
Попробуй еще
УРА!
Попробуй еще
Попробуй еще
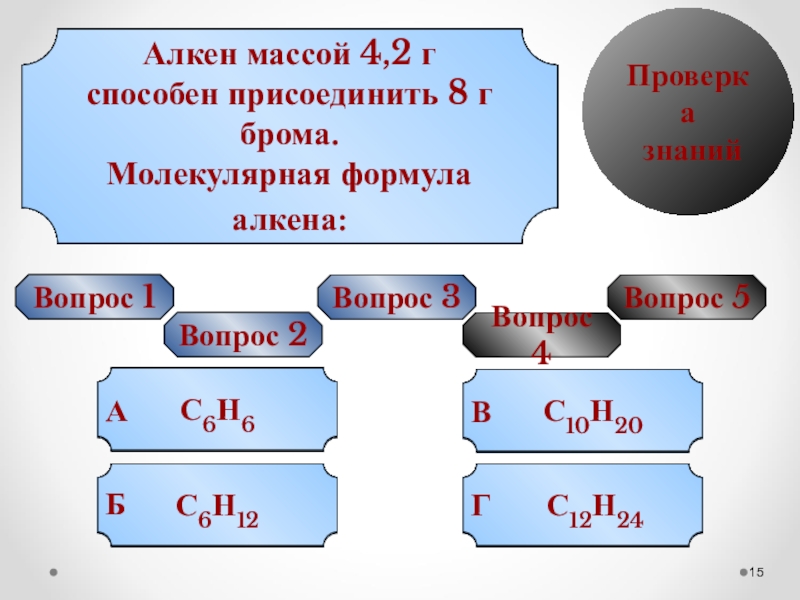
С6Н6
С6Н12
Алкен массой 4,2 г
способен присоединить 8 г брома.
Молекулярная формула алкена:
С12Н24
С10Н20
Г
В
Вопрос 5
Б
А



![Презентация по химии на тему Алкены (10 класс) Химическиесвойства+ Н2, t0, Ni+ Hal2+ HHal+ H2O, t0, H++ H2O + Химическиесвойства+ Н2, t0, Ni+ Hal2+ HHal+ H2O, t0, H++ H2O + [O]+ O2, t0 (горение)- H2, t0,](/img/thumbs/c6f71c4b7ea9b88e949a37069036825a-800x.jpg)