- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Алканы
Содержание
- 1. Презентация по химии на тему Алканы
- 2. 1. Получение, физические и химические свойства. 2. Применение алканов.
- 3. СН4 до С4Н10 - газы,С5Н12 - С17Н36
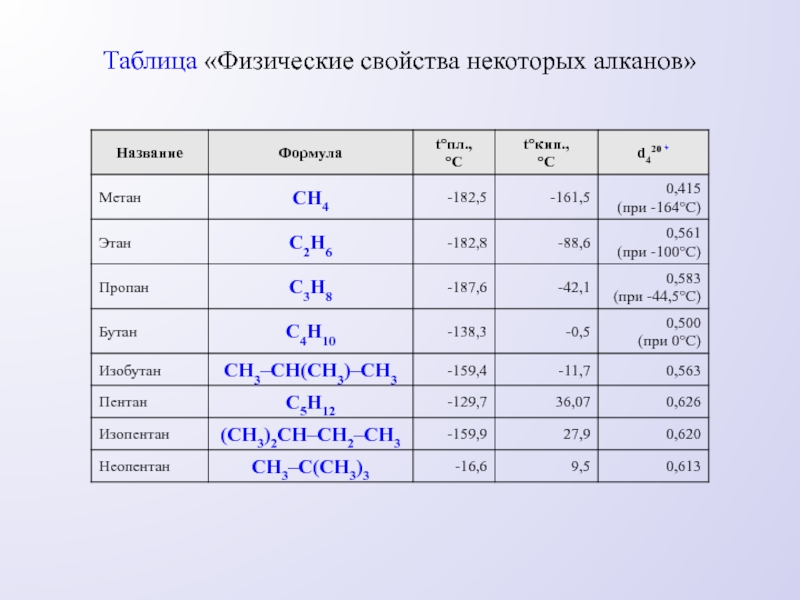
- 4. Таблица «Физические свойства некоторых алканов»
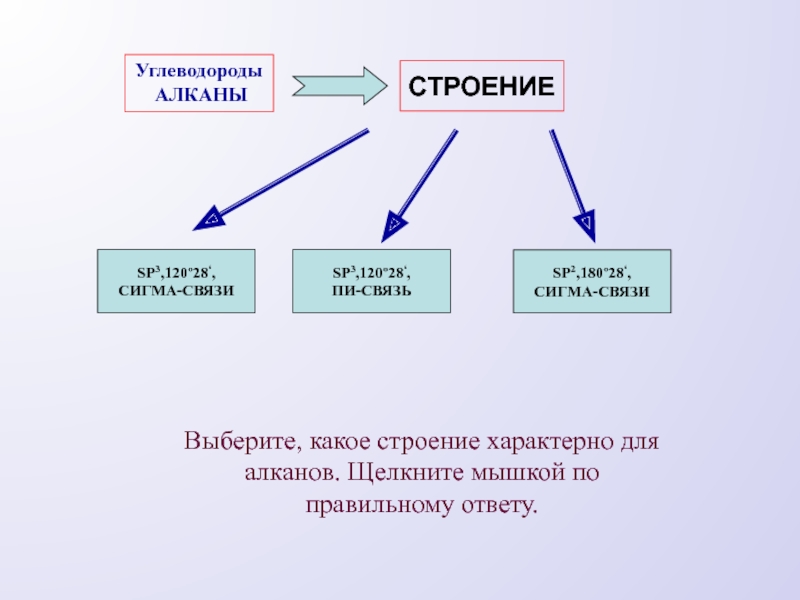
- 5. Углеводороды АЛКАНЫСТРОЕНИЕSP3,120º28‘,СИГМА-СВЯЗИSP3,120º28‘,ПИ-СВЯЗЬSP2,180º28‘,СИГМА-СВЯЗИВыберите, какое строение характерно для алканов. Щелкните мышкой по правильному ответу.
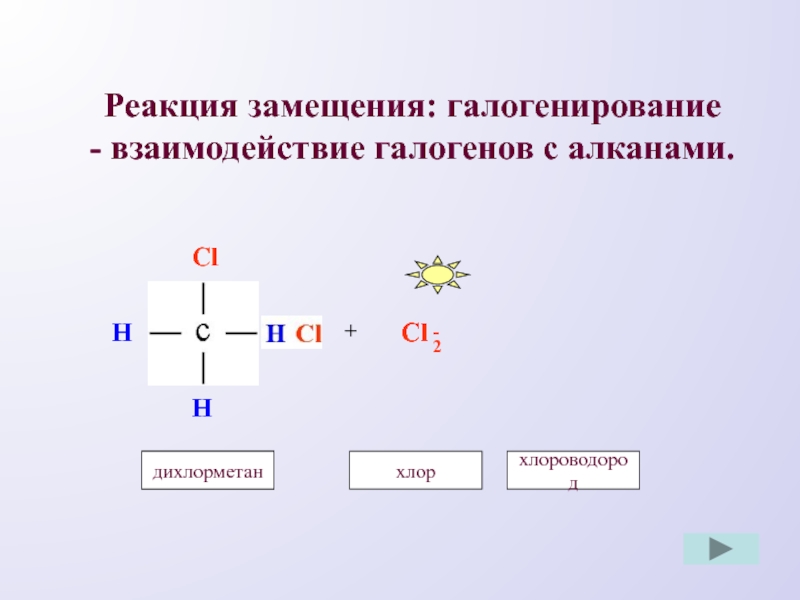
- 6. Реакция замещения: галогенирование - взаимодействие галогенов с алканами.ClHHH+Cl-Cl2хлорметанхлордихлорметанхлороводород
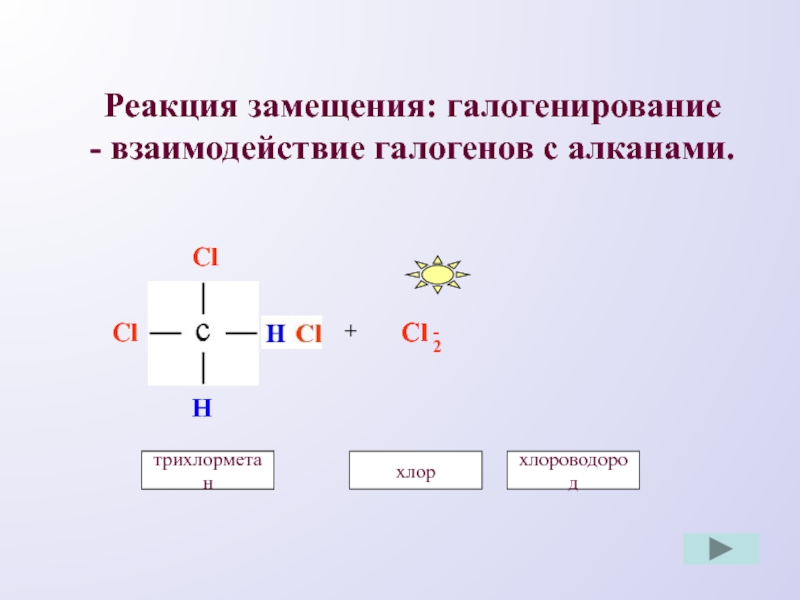
- 7. Реакция замещения: галогенирование - взаимодействие галогенов с алканами.ClHHCl+Cl-Cl2дихлорметанхлортрихлорметанхлороводород
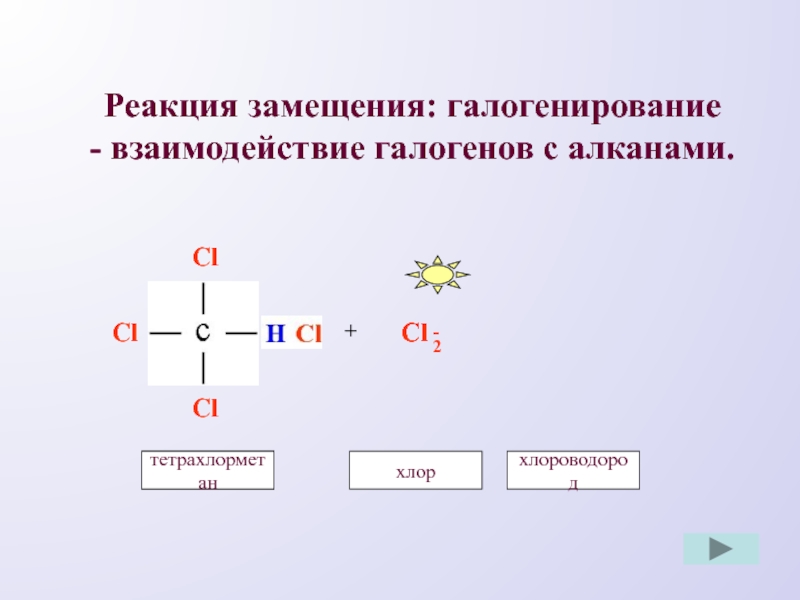
- 8. Реакция замещения: галогенирование - взаимодействие галогенов с алканами.ClHClCl+Cl-Cl2трихлорметанхлортетрахлорметанхлороводород
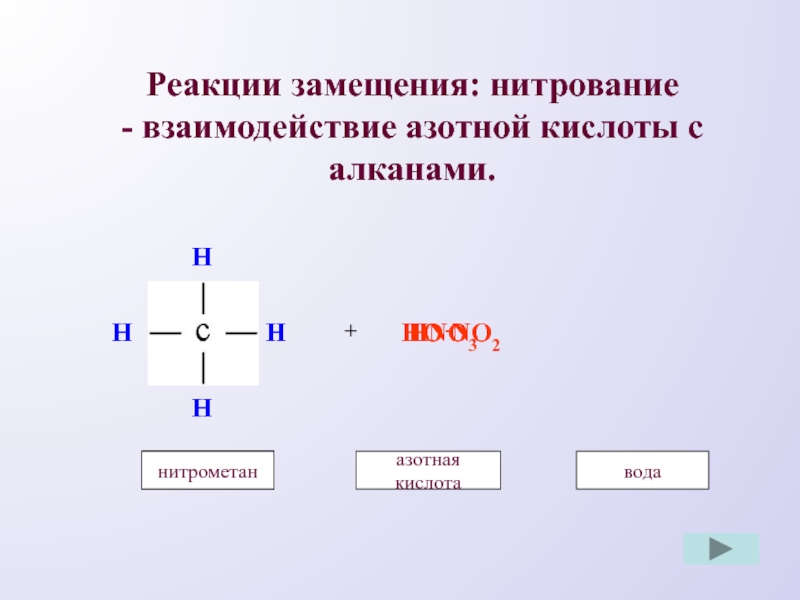
- 9. Реакции замещения: нитрование - взаимодействие азотной кислоты с алканами.HHHH+HO-HNO3метаназотная кислотаметанводаNO2нитрометан
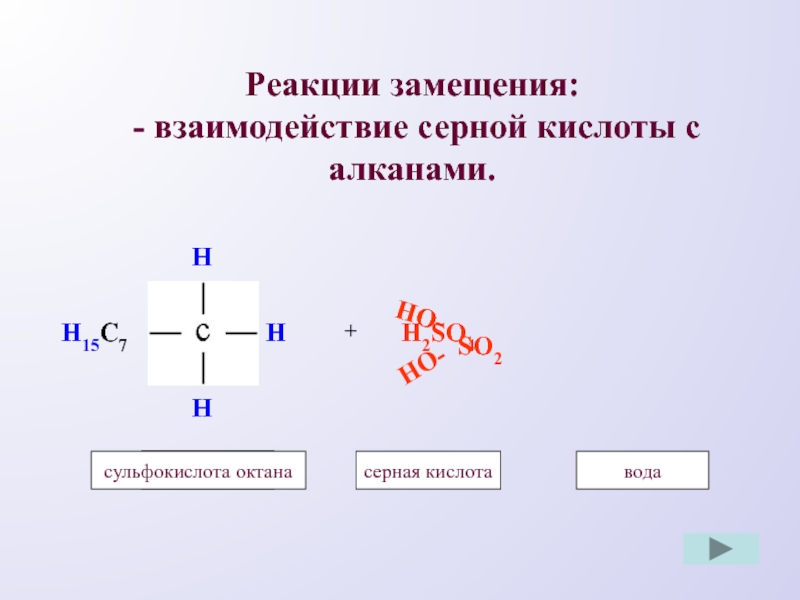
- 10. Реакции замещения: - взаимодействие серной кислоты с алканами.HHHH15C7+HO-H2SO4метансерная кислотаметанводаSO2октанHO-сульфокислота октана
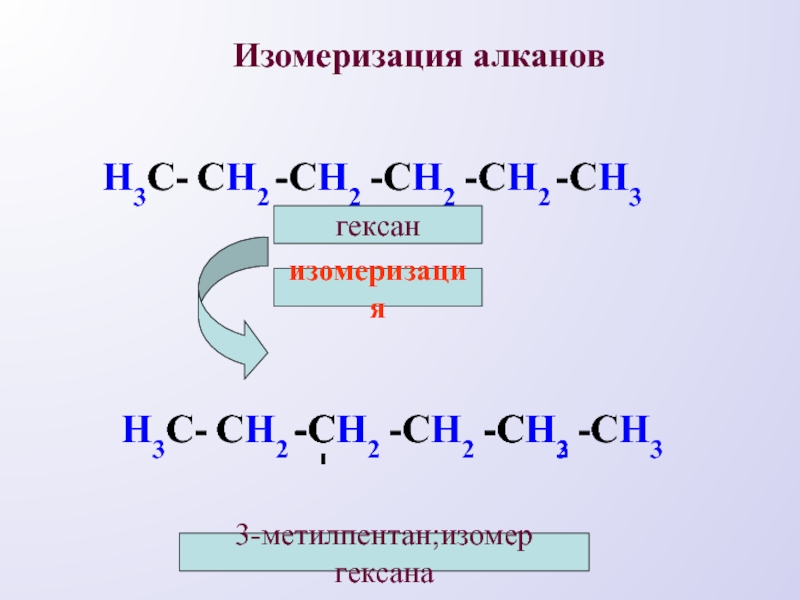
- 11. Изомеризация алкановН3С-СH2-СH2-СH2-СH2-СH3изомеризациягексанН3С-СH2-СH2-СH2-СH2СH3-СH--СH3-3-метилпентан;изомер гексана
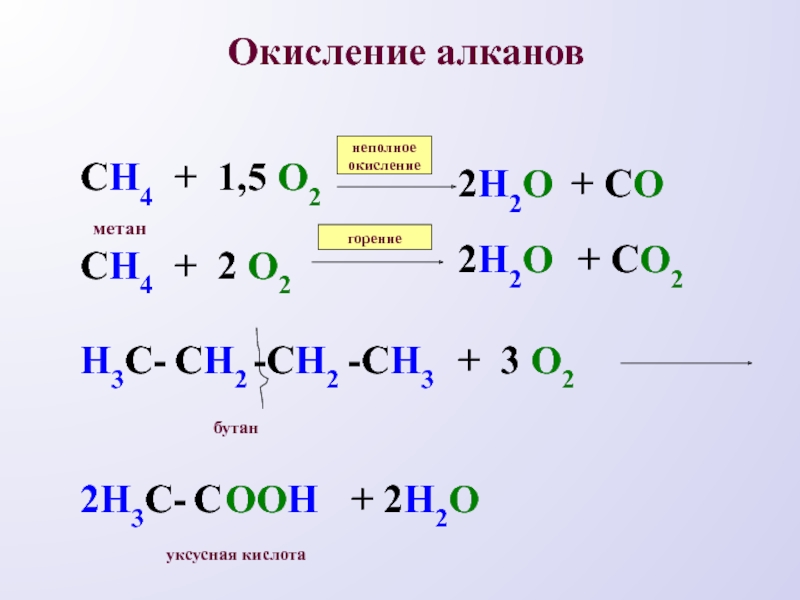
- 12. Окисление алкановСH4СH4+ 1,5 О2+ 2 О22H2O+ CO2H2O+ CO2неполноеокислениегорениеметанН3С-СH2-СH2-СH32Н3С-СООH+ 3 О2+ 2H2Oбутануксусная кислота
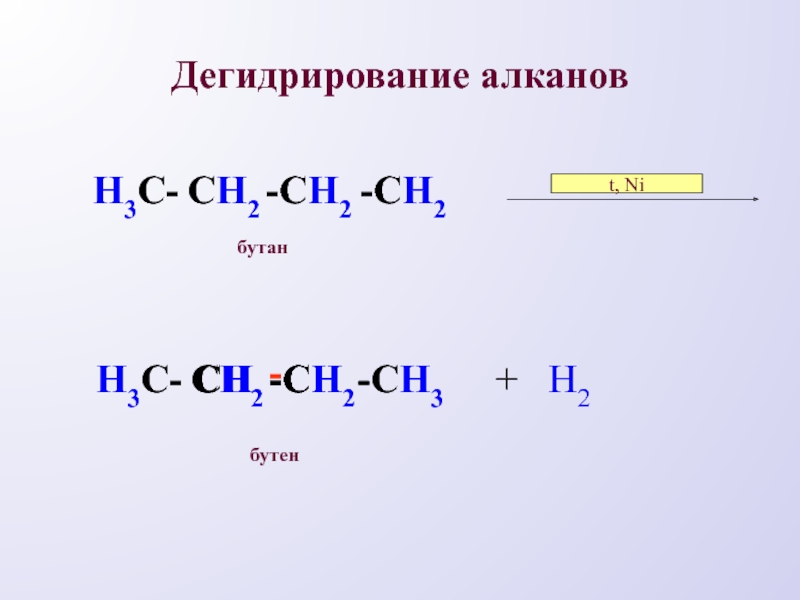
- 13. Дегидрирование алкановН3С-СH2-СH3--СHСH-СH2Н3С-СH2-СH2-СH2t, Ni+ H2бутанбутен
- 14. Получение алканов1) гидрирование угля под давлением в
- 15. Д/ЗСоставьте сообщение о применении алканов (для всех
- 16. ошибкаВернитесь назад
1. Получение, физические и химические свойства. 2. Применение алканов.
Слайд 3СН4 до С4Н10 - газы,
С5Н12 - С17Н36 - жидкости,
С18Н38 - твердые
тела.
Температуры плавления и кипения алканов зависят от их плотности и увеличиваются с ростом молекулярной массы. Все алканы легче воды, в ней не растворимы, однако растворимы в неполярных растворителях и сами являются хорошими растворителями.
Температуры плавления и кипения алканов зависят от их плотности и увеличиваются с ростом молекулярной массы. Все алканы легче воды, в ней не растворимы, однако растворимы в неполярных растворителях и сами являются хорошими растворителями.
ФИЗИЧЕСКИЕ СВОЙСТВА
Слайд 5Углеводороды
АЛКАНЫ
СТРОЕНИЕ
SP3,120º28‘,
СИГМА-СВЯЗИ
SP3,120º28‘,
ПИ-СВЯЗЬ
SP2,180º28‘,
СИГМА-СВЯЗИ
Выберите, какое строение характерно для алканов. Щелкните мышкой по правильному
ответу.
Слайд 6Реакция замещения: галогенирование
- взаимодействие галогенов с алканами.
Cl
H
H
H
+
Cl
-
Cl
2
хлорметан
хлор
дихлорметан
хлороводород
Слайд 7Реакция замещения: галогенирование
- взаимодействие галогенов с алканами.
Cl
H
H
Cl
+
Cl
-
Cl
2
дихлорметан
хлор
трихлорметан
хлороводород
Слайд 8Реакция замещения: галогенирование
- взаимодействие галогенов с алканами.
Cl
H
Cl
Cl
+
Cl
-
Cl
2
трихлорметан
хлор
тетрахлорметан
хлороводород
Слайд 9Реакции замещения: нитрование
- взаимодействие азотной кислоты с алканами.
H
H
H
H
+
HO
-
HNO3
метан
азотная кислота
метан
вода
NO2
нитрометан
Слайд 10Реакции замещения:
- взаимодействие серной кислоты с алканами.
H
H
H
H15C7
+
HO-
H2SO4
метан
серная кислота
метан
вода
SO2
октан
HO-
сульфокислота октана
Слайд 11Изомеризация алканов
Н3С-
СH2
-СH2
-СH2
-СH2
-СH3
изомеризация
гексан
Н3С-
СH2
-СH2
-СH2
-СH2
СH3
-СH
-
-СH3
-
3-метилпентан;изомер гексана
Слайд 12Окисление алканов
СH4
СH4
+ 1,5 О2
+ 2 О2
2H2O
+ CO
2H2O
+ CO2
неполное
окисление
горение
метан
Н3С-
СH2
-СH2
-СH3
2Н3С-
С
ООH
+ 3 О2
+ 2H2O
бутан
уксусная
кислота
Слайд 14Получение алканов
1) гидрирование угля под давлением в присутствии катализаторов (железо, кобальт,
никель);
n C + (n+1) H2 CnH2n+2
2) гидрирование оксида углерода под давлением в присутствии катализаторов (железо, кобальт, никель);
n CO + (2n+1) H2 CnH2n+2+ n H2O
3) гидрирование непредельных или циклических углеводородов в присутствии катализаторов (платины, палладия, никеля);
R–CH=CH–R' + H2 R–CH2–CH2–R'
n C + (n+1) H2 CnH2n+2
2) гидрирование оксида углерода под давлением в присутствии катализаторов (железо, кобальт, никель);
n CO + (2n+1) H2 CnH2n+2+ n H2O
3) гидрирование непредельных или циклических углеводородов в присутствии катализаторов (платины, палладия, никеля);
R–CH=CH–R' + H2 R–CH2–CH2–R'
4) реакция Вюрца;
2CH3–CH2Br + 2Na CH3–CH2–CH2–CH3 + 2NaBr
бромистый этил бутан
циклопропан
+ H2 –– CH3 –CH2 –CH3
Pd
пропан
5) крекинг нефти.
Слайд 15Д/З
Составьте сообщение о применении алканов (для всех задание);
Объясните на примере предельных
углеводородов следующую взаимосвязь:
СТРОЕНИЕ СВОЙСТВА ПРИМЕНЕНИЕ
(ЗАДАНИЕ ВЫПОЛНЯЕТСЯ ПО ЖЕЛАНИЮ)
СТРОЕНИЕ СВОЙСТВА ПРИМЕНЕНИЕ
(ЗАДАНИЕ ВЫПОЛНЯЕТСЯ ПО ЖЕЛАНИЮ)