- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Алканы
Содержание
Слайд 2 Природный газ
Природный газ-это
Слайд 3
Алканы-это предельные углеводороды, в молекулах которых все атомы связаны одинарными связями. Состав их отражает общая формула CnH2n+2. Свое название “ предельные углеводороды” алканы получили потому, что все валентности атомов углерода в этих молекулах насыщены атомами водорода до предела.
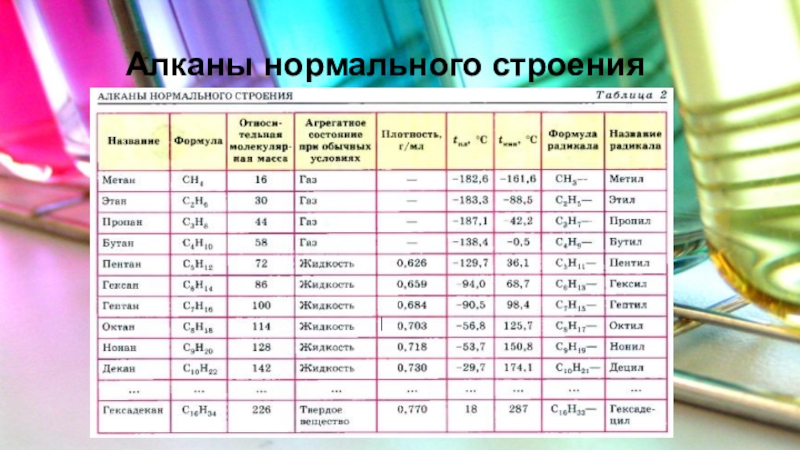
Слайд 4 Физические свойства алканов
Физические свойства алканов зависят от состава их молекул, т.е от относительной молекулярной массы. С увеличением относительной молекулярной массы у алканов увеличивается температура кипения и плотность, а также меняется агрегатное состояние: первые четыре алкана - газообразные вещества, следующие одиннадцать - жидкости, а начиная с гексадекана - твердые вещества.
Слайд 5 Система названий
Так как,
Слайд 7 Правила составления названий
В структурной формуле выбирают самую длинную
Атомы углерода главной цепи нумеруют , начиная с того конца, к которому ближе разветвление
В начале названия перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они связаны . Если в молекуле присутствует несколько одинаковых радикалов , то цифрой указывают место каждого из них в главной цепи и перед их названием ставят соответственно частицы ди-, три-, тетра-, и т.д.
Основой названия служит наименование предельного углеводорода с тем же числом атомов углерода, что и в главной цепи.
Слайд 8 Применение природного газа
Основным химическим свойством предельных углеводородов, определяющим
СxHy+(x+0.5y)O2→xCO2 + 0.5yH2O.
Слайд 9 Применение природного газа
Так же, природный газ
Для них, как для предельных углеводородов, наиболе характерны реакции замещения.
Метан вступает в реакции полного и неполного разложения в зависимости от условий реакции. При температуре 1000 °С происходит полное разложение метана. При этом образуются сажа и водород :
CH4→C + 2H2
Слайд 10 Применение природного газа
Сажа идет на изготовление
Неполное разложение метана проводят при температуре 1500°С и резком охлаждении продуктов реакции. В результате этого процесса получают важный углеводород ацетелен C2H2, а так же водород:
2CH4→C2H2 + 3H2
Слайд 11
В присутствии катализаторов от молекул алканов отщепляются молекулы водорода.
Реакции отщепления молекул водорода от молекул органического соединения называют реакциями дегидрирования.
Например, дегидрированием этана получают этилен - ценный химический продукт :
CH3 - CH3 →CH2=CH2+H2