- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему АЛКАНЫ
Содержание
- 1. Презентация по химии на тему АЛКАНЫ
- 2. План.Определение. Общая формула класса углеводородов.Гомологический ряд.Виды изомерии.Строение алканов.Физические свойства.Способы получения.Химические свойства.Применение.
- 3. Алканы. (Предельные углеводороды. Парафины. Насыщенные углеводороды.)Алканы
- 4. Гомологический ряд метанаСН4
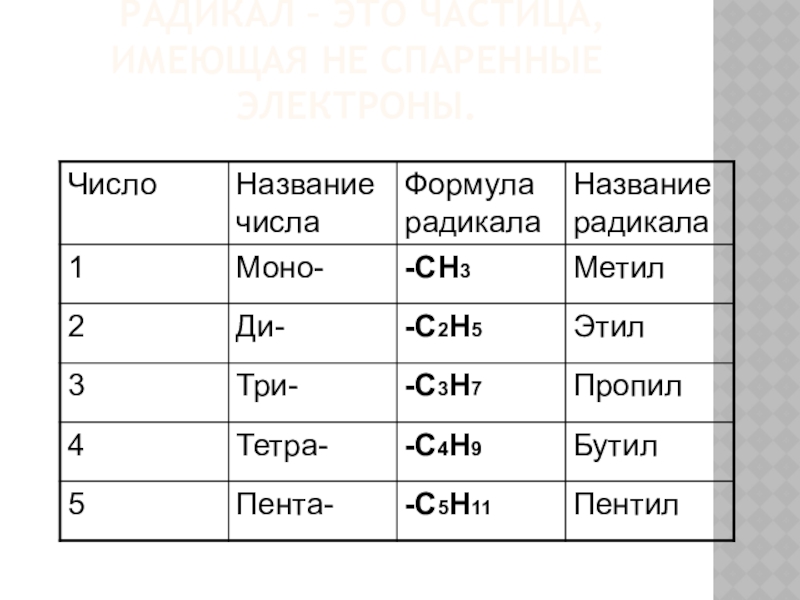
- 5. Радикал – это частица, имеющая не спаренные электроны.
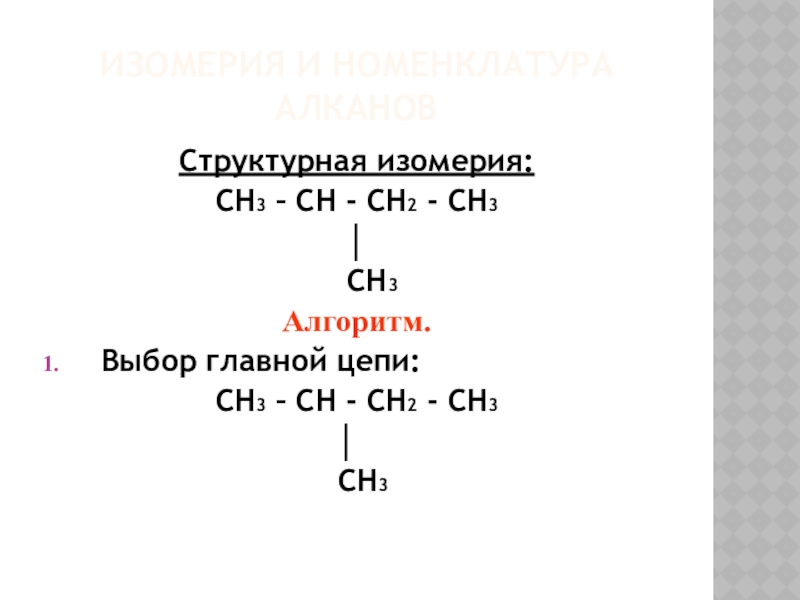
- 6. Изомерия и номенклатура алкановСтруктурная изомерия:CH3 – CH
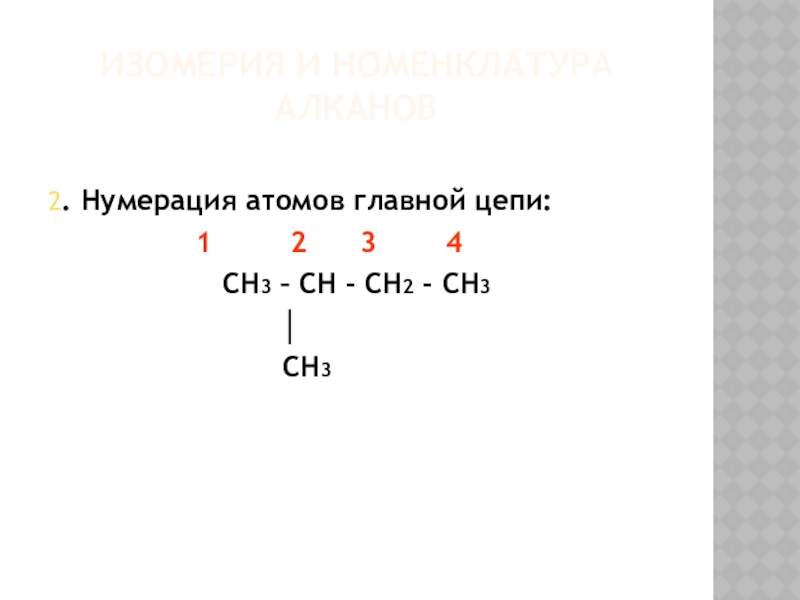
- 7. Изомерия и номенклатура алканов2. Нумерация атомов главной
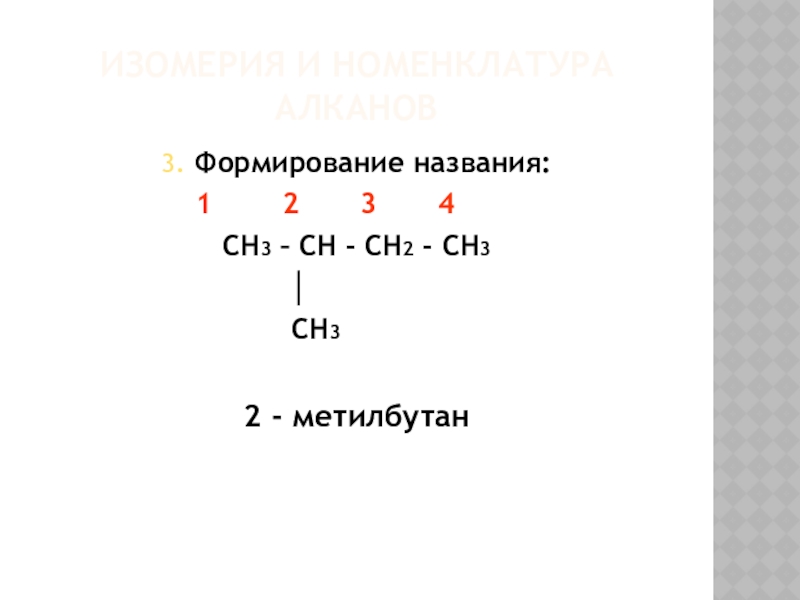
- 8. Изомерия и номенклатура алканов3. Формирование названия:
- 9. Метан Для алканов характерна sp³-гибридизация; Длина С-С
- 10. Строение гомологов метана
- 11. Строение алканов
- 12. Строение алканов
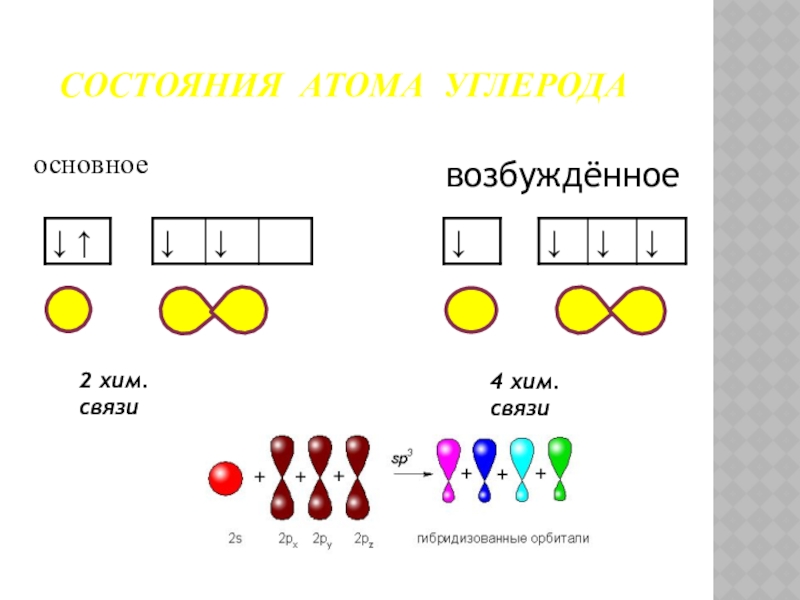
- 13. 2 хим. связи4 хим. связиСОСТОЯНИЯ АТОМА УГЛЕРОДА основноевозбуждённое
- 14. Молекулярная формулаCH4Угол между связями HCH 109°28`строение тетраэдрическоеСТРОЕНИЕ МОЛЕКУЛЫ МЕТАНА
- 15. Физические свойстваС увеличением относительных молекулярных масс
- 16. В промышленности: а) крекинг нефтепродуктов:
- 17. Получение метана
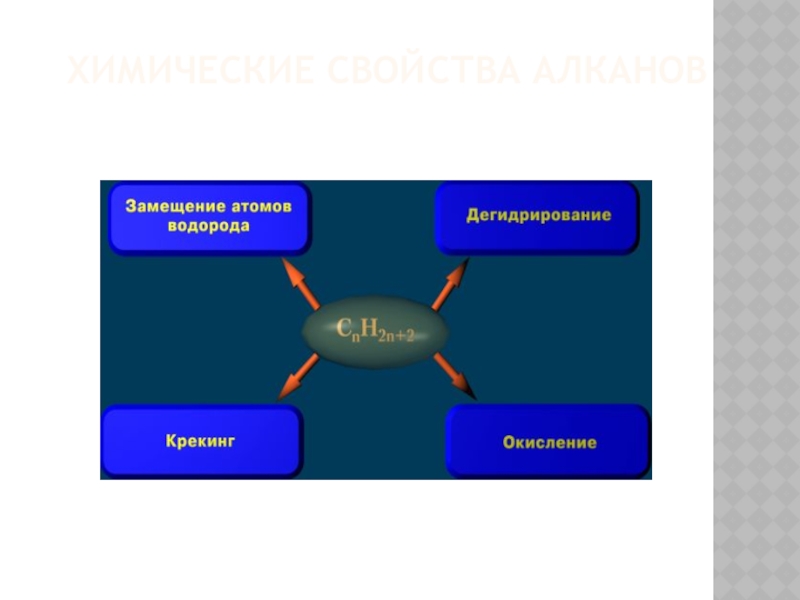
- 18. Химические свойства алканов
- 19. СН4 + Сl2 CH3Cl
- 20. 2. Реакции изомеризации:СН3
- 21. 6. Реакция горения: CH4 + 2O2 → CO2 + 2H2O + Q
- 22. Широкоиспользуются в качестветоплива, в том числе длядвигателей внутреннегосгорания. Применение алканов
- 23. Применение алканов1-3 – производство сажи(1 – картрижи;2
- 24. Закрепление.Составьте все возможные изомеры для гептана и
- 25. Домашнее задание§ 10 упр. 1-11(стр. 86)
Слайд 1Тема урока
Алканы.
Учитель химии
МБОУ «Мэндигинская
СОШ имени П.И. Караканова»
Иванова Ыйдана Семеновна
Слайд 2План.
Определение. Общая формула класса углеводородов.
Гомологический ряд.
Виды изомерии.
Строение алканов.
Физические свойства.
Способы получения.
Химические свойства.
Применение.
Слайд 3Алканы. (Предельные углеводороды.
Парафины. Насыщенные углеводороды.)
Алканы - углеводороды в молекулах которых
CnH2n+2
Слайд 4Гомологический ряд метана
СН4 метан
С2H6 этан
C3H8 пропан
C4H10 бутан
C5H12 пентан
C6H14 гексан
C7H16 гептан
C8H18 октан
C9H20 нонан
C10H22 декан
Гомологи – это вещества, сходные по строению и свойствам
и отличающиеся на одну или более групп СH2.
Слайд 6Изомерия и номенклатура алканов
Структурная изомерия:
CH3 – CH - CH2 - CH3
CH3
Алгоритм.
Выбор главной цепи:
CH3 – CH - CH2 - CH3
│
CH3
Слайд 7Изомерия и номенклатура алканов
2. Нумерация атомов главной цепи:
CH3 – CH - CH2 - CH3
│
CH3
Слайд 8Изомерия и номенклатура алканов
3. Формирование названия:
CH3 – CH - CH2 - CH3
│
CH3
2 - метилбутан
Слайд 9Метан
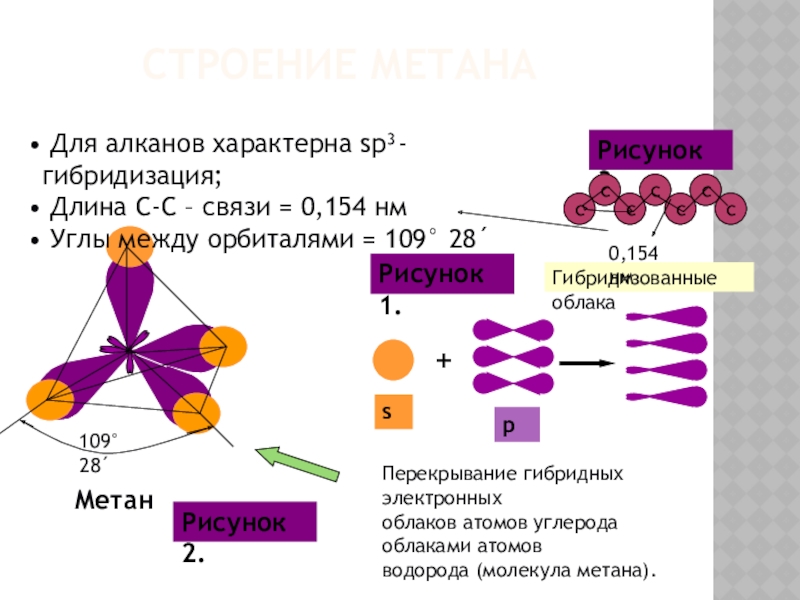
Для алканов характерна sp³-гибридизация;
Длина С-С – связи = 0,154
Углы между орбиталями = 109° 28´
Перекрывание гибридных электронных
облаков атомов углерода облаками атомов
водорода (молекула метана).
+
109°28´
Строение метана
s
р
Гибридизованные облака
Рисунок 1.
Рисунок 2.
Рисунок 3.
c
c
c
c
c
c
c
0,154 нм
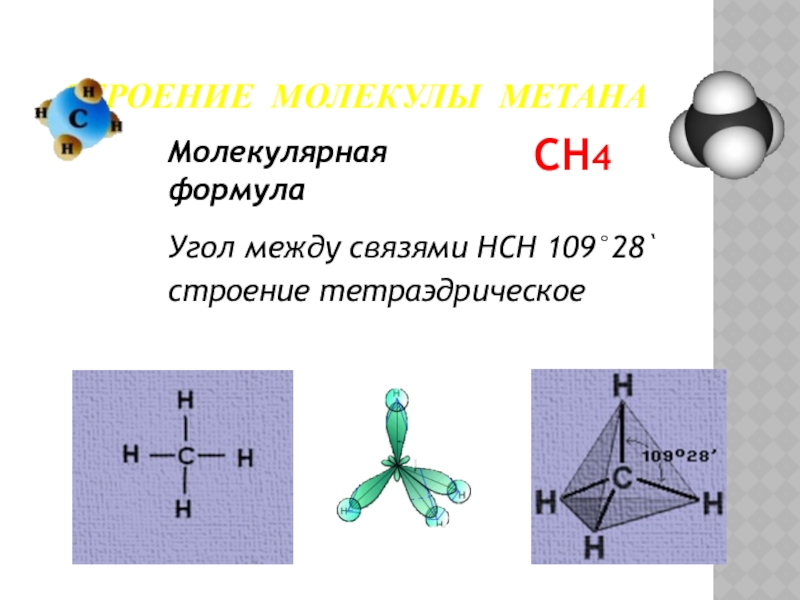
Слайд 14Молекулярная формула
CH4
Угол между связями HCH 109°28`
строение тетраэдрическое
СТРОЕНИЕ МОЛЕКУЛЫ МЕТАНА
Слайд 15
Физические свойства
С увеличением относительных молекулярных масс предельных углеводородов закономерно повышаются
СН4…C4Н10 – газы
T кипения:
-161,6…-0,5 °C
T плавления:
-182,5…-138,3 °C
С16Н34…и далее– твёрдые вещества
T кипения:
287,5 °C
T плавления:
20 °C
С5Н12…C15Н32 – жидкости
T кипения:
36,1…270,5 °C
T плавления:
-129,8…10 °C
Слайд 16В промышленности:
а) крекинг нефтепродуктов:
C16H34
2) В лаборатории:
Получение
в) Декарбоксилирование натриевых солей карбоновых солей:
СН3СООNa + 2NaОН → СН4 ↑ + Nа2СО3
б) Реакция Вюрца:
C2H5Cl + 2Na → C4H10 + 2NaCl
а) Гидролиз карбидов:
Al4C3 +12 H2O = 3 CH4 + 4 Al(OH)3↓
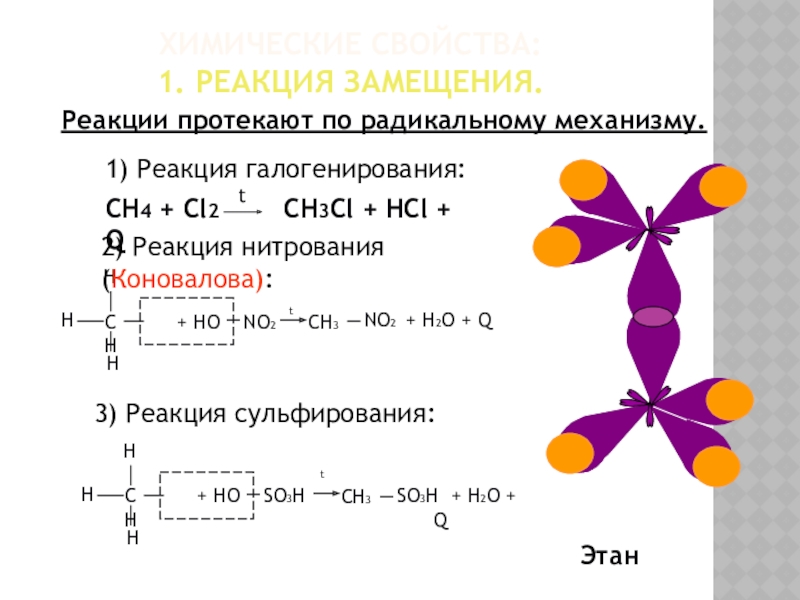
Слайд 19СН4 + Сl2 CH3Cl + HCl + Q
Реакции протекают по радикальному механизму.
Этан
С Н
Н
Н
Н
+ НО NO2
СН3
NO2
+ H2O + Q
С Н
Н
Н
Н
+ НО SO3H
СН3
SO3H
+ H2O + Q
t
t
Химические свойства:
1. Реакция замещения.
2) Реакция нитрования (Коновалова):
3) Реакция сульфирования:
1) Реакция галогенирования:
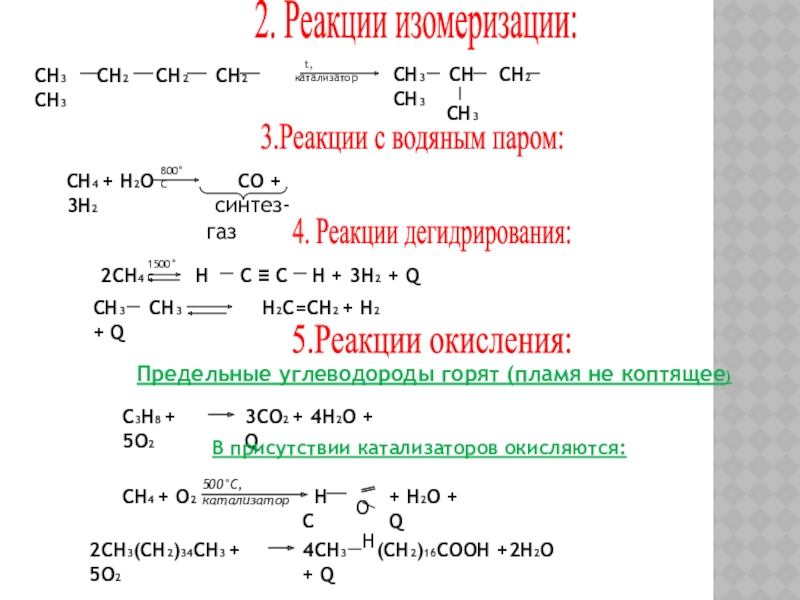
Слайд 202. Реакции изомеризации:
СН3 СН2
t, катализатор
СН3 СН СН2 СН3
СН3
3.Реакции с водяным паром:
СН4 + Н2О СО + 3Н2
800°С
синтез-газ
4. Реакции дегидрирования:
2СН4 Н С ≡ С Н + 3Н2 + Q
1500°С
СН3 СН3 Н2С=СН2 + Н2 + Q
5.Реакции окисления:
Предельные углеводороды горят (пламя не коптящее)
С3Н8 + 5О2
3СО2 + 4Н2О + Q
В присутствии катализаторов окисляются:
СН4 + О2
500°С, катализатор
Н С
О
Н
+ Н2О + Q
2СН3(СН2)34СН3 + 5О2
4СН3 (СН2)16СООН +2Н2О + Q
Слайд 22Широко
используются в
качестве
топлива, в том
числе для
двигателей
внутреннего
сгорания.
Применение алканов
Слайд 23Применение алканов
1-3 – производство сажи
(1 – картрижи;
2 – резина;
3 – типографическая
4-7 – получение
органических веществ
(4 – растворителей;
5 – хладогентов,
используемых
в холодильных установках;
6 – метанол;
7 - ацетилен)
Слайд 24Закрепление.
Составьте все возможные изомеры для гептана и назовите их.
Составьте 2 ближайших
Определить предельный углеводород, плотность паров которого по воздуху равна 2.
Учебник: 1-7 задачи(стр. 28)